Эквивалент. Закон эквивалентов
СОДЕРЖАНИЕ
СОДЕРЖАНИЕ. 3
ВВЕДЕНИЕ 5
1. Эквивалент. Закон эквивалентов. 7
2. ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ. 8
3. МОЛЬ. ЗАКОН АВОГАДРО. МОЛЬНЫЙ ОБЪЕМ ГАЗА. 9
4. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНЫХ МАСС ВЕЩЕСТВ В ГАЗООБРАЗНОМ СОСТОЯНИИ 10
5. ВЫВОД ХИМИЧЕСКИХ ФОРМУЛ. РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ 11
6. СТРОЕНИЕ АТОМА. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ. ЗАВИСИМОСТЬ СВОЙСТВ ЭЛЕМЕНТОВ ОТ СТРОЕНИЯ ИХ АТОМОВ. 12
7. ХИМИЧЕСКАЯ СВЯЗЬ. ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ. 13
8. ПОЛЯРНОСТЬ МОЛЕКУЛ. ГЕОМЕТРИЧЕСКАЯ СТРУКТУРА МОЛЕКУЛ 14
9. ИОННАЯ СВЯЗЬ. ПОЛЯРИЗАЦИЯ ИОНОВ. 15
10. ВОДОРОДНАЯ СВЯЗЬ. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ 16
11. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ 16
11.1. Энергетика химических реакций. 16
11.2. Скорость химических реакций. Химическое равновесие ……….19
Лабораторная работа № 1……………………………………….…… . 21
Лабораторная работа № 2………………………………………… …. 29
Лабораторная работа № 3…………………………………………… .. 42
Лабораторная работа № 4…………………………………………… . 51
Лабораторная работа № 5…………………………………………… 60
Лабораторная работа № 6………………………………………… …. 66
Литература………………………………………………………………...72
Введение
В связи со все возрастающей компьютеризацией проведение лабораторных работ по химии для студентов академии с использованием компьютерных программ, демонстрирующих химические опыты, представляется целесообразным. Компьютерная программа по химии помимо развития практических навыков работы на персональном компьютере, дает возможность для самостоятельного и дистанционного обучения, что важно не только для студентов дневного отделения, но и для студентов заочной и дистанционной формы обучения.
Методическое пособие, содержащее необходимую теоретическую часть, создает возможность выполнения лабораторных работ на компьютере в домашних условиях. Аудиторное время занятий более полно может быть использовано для более основательного разбора теоретических основ химических процессов.
Лабораторные работы охватывают основные свойства химических элементов периодической системы Д.И. Менделеева по группам и подгруппам, также изучается электронное строение атомов и типы химических связей на примерах молекул некоторых веществ, наблюдаются и изучаются процессы электролиза.
В теоретической части содержатся некоторые основные понятия и представления, являющиеся общими для различных дисциплин естественно научного направления.
Задачи по химии
1. При сгорании 5 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла.
2. Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,17 г одного из галогенов. Определить эквивалентную массу галогена.
3. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода рас-ходуется при сгорании 21 г магния, эквивалент которого равен 1/2 моля?
4. Выразить в граммах массу одной молекулы диоксида серы.
5. Какой объем при нормальных условиях занимают 27 × 10  молекул газа?
молекул газа?
6. Определить объем, занимаемый 0,07 кг N 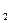 при температуре 294 К и давлении 142 кПа.
при температуре 294 К и давлении 142 кПа.
7. Плотность этилена по кислороду равна 0, 875. Определить молекулярную массу этилена.
8. Какой объем займет 1 кг воздуха при 290 К и давлении 101,33 кПа?
9. Вычислить мольную массу газа, если масса 600 мл его при нормальных условиях равна 1,714 г.
10. Найти простейшую формулу вещества, содержащего (по массе) 43,4% натрия, 11,3% углерода и 45,3% кислорода.
11. Найти молекулярную формулу вещества, содержащего (по массе) 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
12. К раствору, содержащему 6,8 г AlCl 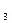 , прилили раствор, содержащий 5г КОН. Найти массу образовавшегося осадка. .
, прилили раствор, содержащий 5г КОН. Найти массу образовавшегося осадка. .
13. Какой подуровень заполняется после заполнения подуровня 5р? После заполнения подуровня 5d?
14. Записать электронные формулы атомов элементов с зарядом ядра: а) 15, б) 20, в) 35, г) 50. Составить графические схемы заполнения электронами валентных орбиталей этих атомов.
15. Сколько вакантных 3d-орбиталей имеют возбужденные атомы хлора, ванадия, марганца?
16. Вычислить разность электроотрицательностей для связей K-Cl, Ca-Cl, Fe-Cl, Ge-Cl. Какая из связей характеризуется наибольшей степенью ионности?
17. Вычислить разность относительных электроотрицательностей атомов для связей Н-О и О-As. Какая из этих связей более полярна? К какому классу гидроксидов относится As (OH) 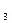 ?
?
18.Объяснить с позиций метода валентных связей способность оксидов NO и NO 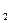 образовывать димерные молекулы.
образовывать димерные молекулы.
19. Длина диполя молекулы фтороводорода равна 4 × 10 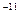 м. Вычислить ее дипольный момент в дебаях и кулон-метрах.
м. Вычислить ее дипольный момент в дебаях и кулон-метрах.
20. Дипольный момент молекулы CS 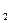 равен нулю. Каким типом гибридизации АО углерода описывается образование этой молекулы?
равен нулю. Каким типом гибридизации АО углерода описывается образование этой молекулы?
21. Исходя из представлений о природе ионной связи, объяснить, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов, а не в виде отдельных молекул.
22. При переходе от CsF к CsI температура плавления кристаллов уменьшается. Объяснить наблюдаемый ход изменения температуры.
23. Какой из перечисленных ионов обладает большим поляризующим действием: а) Na 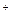 , б) Ca
, б) Ca 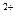 , в) Mg
, в) Mg 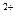 , г) Al
, г) Al  ?
?
24. Какова природа сил Ван-дер-Ваальса? Какой вид взаимодействия между частицами приводит к переходу в конденсированное состояние Ne, N 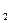 , HI, Cl
, HI, Cl 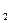 ?
?
25. Температуры кипения трехфтористых азота, фосфора и мышьяка соответственно равны 144, 178, 336 К. Объяснить наблюдаемую закономерность.
26. При восстановлении 12,7 г оксида меди (11) углем (с образованием СО) поглощается 8,24 кДж. Определить D Н0298 образования CuO.
27. Сожжены с образованием воды (газ) равные объемы водорода и ацетилена, взятых при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз?
28. Во сколько раз изменится скорость реакции 2А + В  А
А 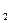 В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
29. При 423 К некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитать, через какое время закончится эта реакция, если ее проводить : а ) при 473 К; б) при 353 К.
Эквивалент. Закон эквивалентов.
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода в химических реакциях.
Эквивалентной массой называется масса 1 эквивалента вещества.
Для определения эквивалента (эквивалентной массы) необязательно исходить из его соединения с водородом. Их можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен.
Согласно закону эквивалентов эквивалентные массы сложных веществ определяют по следующим формулам:
 ;
;
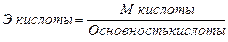 ;
;
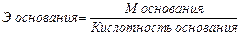 ;
;
 .
.
Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентом вещества. Эквивалентный объем водорода равен 11,2 л/моль.
ПРИМЕР 1. Определить эквивалент и эквивалентные массы элементов в соединениях HBr, H 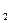 O, NH
O, NH 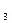 .
.
Решение. В указанных соединениях с 1 молем атомов водорода соединяется 1 моль атомов брома, 1/2 моля атомов кислорода и 1/3 атомов азота. Следовательно, согласно определению, эквиваленты брома, кислорода и азота равны соответственно 1 молю, 1/ 2 моля и 1/ 3 моля. Исходя из мольных масс атомов этих элементов, находим эквивалентные массы этих элементов: у Br она равна 79,9 г/ моль, у кислорода – 16 × 1/2 = 8 г/ моль, у азота- 14 × 1/3 = 4,67 г / моль.
ПРИМЕР 2. При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найти эквивалентную массу железа и его эквивалент, если известно, что эквивалентная масса серы равна
16 г/ моль.
Решение. Из условия задачи следует, что в сульфиде железа на
5,6 г железа приходится 8,8 - 5,6 = 3,2 г серы. Согласно закону эквивалентов, массы взаимодействующих веществ, пропорциональны их эквивалентным массам. Тогда:
5,6 г железа эквивалентны 3,2 г серы,
Э  г/ моль 16 г серы.
г/ моль 16 г серы.
Из соотношения следует, что эквивалентная масса железа равна:
5,6 х 16/ 3,2= 28 г/ моль.
Эквивалент железа равен: 28 г/моль : 56 г/ моль = 1/ 2.
ПРИМЕР 3. Некоторое количество металла, эквивалентная масса которого равна 28 г/ моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Решение. Зная, что эквивалентный объем водорода равен
11,2 л/моль, составляем пропорцию:
28 г металла эквивалентны 11,2 л водорода
Х г металла эквивалентны 0,7 л водорода.
Тогда Х = 0,7 × 28 / 11,2 = 1,75 г.
РЕШИТЬ САМОСТОЯТЕЛЬНО ЗАДАЧИ 1-3
