Структура некоторых молекул и ионов
BF3 + F- = [BF4]-
sp2 sp3
неполярная неполярный
молекула ион
NH3 + H+ = [NH4]+
sp3 sp3
полярная неполярный
молекула ион
искаженный правильный
тетраэдр тетраэдр
Н2О и F2О:
• Обе молекулы полярны, кислород sp3-гибридизован. На двух гибридных орбиталях находятся неподеленные пары электронов, поэтому структура молекул – искаженный тетраэдр. У них разная степень окисления кислорода :
Н2О2- и F2О2+
Задача
Объясните закономерность изменения температуры кипения, наблюдаемую в ряду:
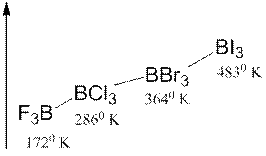
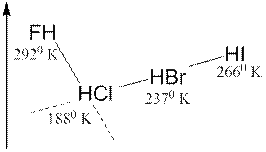
Дисперсионное взаимодействие Ориентационное и дисперсионное взаимодействие
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Основные понятия
Химическая термодинамика рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Поскольку химическое превращение обычно сопровождается высвобождением или поглощением определенного количества теплоты, оно, как и другие явления природы (в том числе электрические и магнитные), сопровождающиеся тепловыми эффектами, подчиняется фундаментальным принципам (началам) термодинамики. Для предсказания направления протекания химических реакций необходимо знать законы обмена энергией между различными телами (системой) и окружающей средой. Изучением этих законов и занимается термодинамика. Термин «термодинамика» впервые появился в статье В.Томсона в 1854г. и в переводе означает «теплота-работа». Еще раньше (в 1849г.) Томсон предложил термин «термодинамический» для характеристики придуманной Сади Карно тепловой машины, производящей работу. Классическая термодинамика рассматривает вещество с точки зрения изменения макроскопических свойств, таких как давление, температура, объем, потенциал и т.п. и не учитывает природу веществ, квантование энергии, не опирается ни на какие модельные представления об атомно-молекулярной структуре веществ. Описанием вещества с точки зрения микроскопических свойств занимается статистическая термодинамика, которая основана на учете строения вещества, квантовых эффектов и позволяет описать макроскопическое поведение системы на основе анализа процессов, протекающих на микроскопическом уровне.
Химическая термодинамика определяет, в первую очередь, условия (такие, как температура и давление) протекания химических реакций и равновесных состояний, которых они достигают.
Термодинамический подход обладает большой общностью, простотой и ведет к решению конкретных задач. При этом остается не раскрытым внутренний механизм явлений. Не отвечает на вопрос «почему?».
Статистическая термодинамика дает строгое обоснование законов и устанавливает границы их применения.
Классическая феноменологическая термодинамика дает полное количественное описание равновесных (обратимых) процессов. Термодинамика неравновесных процессов занимается изучением не сильно отличающихся от равновесных неравновесных (необратимых) процессов.
Химическая термодинамика оперирует с понятием система. Система – это совокупность веществ, находящихся во взаимодействии и мысленно выделенная из окружающей среды.
Взимодействие заключается в обмене энергией и химическом взаимодействии частиц системы. В зависимости от характера взаимодействия системы с окружающей средой различают открытые, закрытые и изолированные системы.
Открытой системой называется система, которая может обмениваться с окружающей средой энергией и массой (веществом). Примером открытой системы может служить живой организм и чашка горячего чая.
Закрытой системой называется система, которая может обмениваться с окружающей средой только энергией. В качестве примера закрытой системы можно привести закрытую банку консервов.
Изолированной системой называется система постоянного объема, в которой не происходит обмена с окружающей средой ни массой, ни энергией. Привести пример изолированной системы затруднительно, т. к. даже Солнечная система является изолированной лишь в первом приближении. В какой-то мере такой системой можно считать закрытый сосуд Дьюара (термос).
Часть системы однородная во всех ее точках по составу и свойствам, отделенная от других ее частей хотя бы одной поверхностью раздела, называется фазой.
Система, состоящая из веществ, находящихся в одной фазе, называется гомогенной.
Система, состоящая из веществ, находящихся в разных фазах и имеющих хотя бы одну поверхность раздела, называется гетерогенной. Например, лед и вода (жидкость) в одном сосуде – гетерогенная двухфазная система.
Компонентом системы называется вещество, которое может быть выделено из системы и существовать вне ее.
Состояние системы определяется ее параметрами. Параметры системы могут быть заданы на молекулярном уровне (координаты, количество движения каждой из молекул, очередность обмена молекул положениями в пространстве, энергией и др. – микроскопические параметры) и на уровне описания состояния всей системы (макроскопические параметры). Любому макроскопическому состоянию системы отвечает множество различных положений и движений молекул, т.е. множество микроскопических состояний. Макроскопических параметров, в отличие от микроскопических, немного, что очень удобно для их практического применения. Параметры состояния системы — это величины, позволяющие определить состояние системы, непосредственно измерив эти величины. В химии чаще всего используются следующие параметры состояния: давление, температура, объем, концентрация и др.
Различают:
экстенсивные параметры состояния, пропорциональные количеству вещества системы: масса, объем, внутренняя энергия и т. п., и интенсивные параметры состояния, не зависящие от количества вещества системы: давление, температура, вязкость и т. п.
Набор параметров системы называется состоянием системы. Макросостояние определяется усредненными параметрами всей совокупности частиц, а микросостояние – параметрами каждой отдельной частицы.
Изменение состояния системы называется процессом.
Различают следующие процессы:
изохорный – процесс, протекающий без изменения объема системы (V = const),
изобарный – процесс, протекающий без изменения давления в системе (p = const),
изотермический – процесс, протекающий без изменения температуры в системе (T = const),
адиабатный – процесс, протекающий без поглощения и выделения системой теплоты (Q = 0).
Процесс называется обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность равновесных промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. Состояние, в котором система характеризуется неизменностью во времени термодинамических параметров называется равновесным термодинамическим состоянием. Выполняются условия механического, термического и химического равновесия. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Процесс, рассматриваемый как непрерывный ряд равновесных состояний системы называется равновесным. Переход системы из неравновесного состояния в равновесное называется релаксацией. Продолжительность (∆t) – временем релаксации. Очевидно, что обратимый процесс – равновесный процесс и в идеале достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называется необратимым.
Так, если уменьшать объем системы, находящейся в равновесии, то при этом увеличится давление (∆P) и возрастет ее температура (∆T) и система в течение времени релаксации придет в другое равновесное состояние. В этом случае процесс можно считать обратимым, если скорость изменения давления (dP/dt) в системе будет меньше скорости изменения давления при релаксации (∆P/∆t):
(dP/dt) << (∆P/∆t)
Важными понятиями термодинамики являются: энергия, теплота и работа.
Энергия — общая количественная мера движения и взаимодействия всех видов материи.
В соответствии с различными формами движения материи энергию разделяют на механическую, электромагнитную, ядерную, тепловую, и т. д. Теплота (Q) — форма беспорядочного (теплового) движения образующих тело частиц (молекул, атомов, электронов и т. д.).
Количественной мерой теплоты служит количество теплоты, т. е. количество энергии, получаемой или отдаваемой системой при теплообмене. Теплота измеряется в единицах энергии: Дж (Джоуль), кал (калория) (1кал = 4,184Дж).
Работа (А) — произведение обобщенной силы на обобщенную координату.
Механическая работа представляется произведением силы на перемещение. Электрическая работа рассматривается как произведение заряда на разность потенциалов. Работа расширения идеального газа равна произведению давления на изменение объема. Здесь сила, давление, разность потенциалов — обобщенная сила, а перемещение, изменение объема, заряд — обобщенная координата.
Теплота и работа являются эквивалентными формами передачи энергии.
Состояние системы определяется различными функциями, называемыми функциями состояния.
Функция состояния — функция независимых параметров системы, изменение которой не зависит от пути перехода системы из начального состояния в конечное, а зависит только от состояния системы в этих точках.
Разделение переменных на параметры состояния и функции состояния достаточно условно, так как в данном случае если X является функцией Y, справедливо и обратное утверждение. За параметры состояния приняты величины, абсолютное значение которых можно непосредственно измерить (температура Т, давление Р, объем V, плотность d, концентрации компонентов С). Функции состояния (внутренняя энергия U, энтальпия Н, энтропия S, энергия Гиббса G) имеют размерность энергии (Джоуль, калория, и.т.д). Для функции состояния можно измерить или рассчитать лишь ее изменение (Δ). Отношение между параметрами и функциями состояния системы аналогично отношению аргументы и функции в математике. Определенному набору параметров системы соответствуют определенные значения функций состояния. Находящуюся в равновесии гомогенную систему можно, очевидно, однозначно определить измерив концентрации всех ее веществ, температуру и объем. Изменение функции состояния рассматривается как разность ее значений в конечном и исходном состояниях системы, например,
ΔХ = Х2 - Х1
Индексы «1» и «2» характеризуют начальное и конечное состояния системы, соответственно.
Теплота и работа не являются функциями состояния системы и зависят от пути перехода системы из одного состояния в другое.
