Задача 2 Направленность химических процессов, скорость и равновесие
Задача 1 Энергетика химических процессов
Условие задачи: Вычислите теплоту образования подчеркнутого в уравнении вещества, исходя из термохимических уравнений.
| № варианта | Уравнение реакции | DHХР, кДж | Ответы DHОБРАЗ, кДж/моль |
| 1) 4NH3 + 5O2 = 4NO + 6H2O (Ж) 2) 4NH3 + 3O2 = 2N2 + 6H2O (Ж) | —1169 —1530 | ||
| 1) 4As + 3O2 = 2As2O3 2) As2O3 + O2 = As2O5 | -1328 -261 | -925 | |
| 1) CuCl2 + Cu = 2CuCl 2) Cu + Cl2 = CuCl2 | —56 —216 | —136 | |
| 1) 2P + 3Cl2 = 2PCl3 2) PCl5 = PCl3 + Cl2 | -574 | -375 | |
| 1) 2Pb + O2 = 2PbO 2) 2PbO2 = 2PbO + O2 | -438 | -277 |
Условие задачи: Рассчитайте тепловой эффект указанной реакции, исходя из стандартных теплот образования (табл. 1). Вычислите также количество теплоты (Q), которое выделится или поглотится, если в данную реакцию вступило m г первого вещества.
| № задачи | Уравнение реакции | m г | Ответы Q, кДж |
| H2S(Г) + CO2(Г) = H2O(Г) + COS(Г) | |||
| S(Т) + 2CO2(Г) = SO2(Г) + 2CO(Г | |||
| CO2(Г) + 4H2(Г) = CH4(Г) + 2H2O(Г) | -332 | ||
| PCl5(Г) + H2O(Г) = POCl3(Ж) + 2HCl (Г) | -680 | ||
| 2NaHCO3(Т) = Na2CO3(Т) + H2O(Г) + CO2(Г) |
Условие задачи: Вычислите тепловой эффект указанной реакции, исходя из стандартных теплот сгорания (табл. 2). Вычислите также количество теплоты, которое выделится или поглотится, если в данную реакцию вступило V л первого газа.
| № задачи | Уравнение реакции | V, л | Ответы Q, кДж |
| 2СH4 (Г) + О2(Г) = 2СО(Г) + 4Н2(Г | 89,6 | -140 | |
| 2NH3(Г) + 2O2(Г) " N2O(Г) + 3H2O(Г) | 67,2 | -1045,5 | |
| C2H2 (Г) + 2CO2(Г) = 4CO(Г) + H2 (Г) | |||
| CH4 (Г) + CO2(Г) = 2CO(Г) + 2H2 (Г) | 44,8 | ||
| C2H6 (Г) + H2(Г) = 2CH4 (Г) | -165 |
Условие задачи: Рассчитайте стандартную теплоту образования первого в уравнении вещества, исходя из приведенного термохимического уравнения реакции и данных по DHОБРАЗ (табл 1).
| № задачи | Уравнение реакции | DHХР, кДж/моль |
| 2Al2O3(Т) + 6SO2(Г) + 3O2(Г) = 2Al2(SO4)3(Т) | -1736 | |
| 4NO2(Г) + O2(Г) + 2H2O(Ж) = 4HNO3(Ж) | -252 | |
| 2Mg(NO3)2(Т) = 2MgO(Т) + 4NO2(Г) + O2(Г) | ||
| 2CuO(Т) + 4NO2(Г) + O2(Г) = 2Cu(NO3)2(Т) | -416 | |
| 4Na2SO3 (Т) = 3Na2SO4(Т) + Na2S (Т) | -176 |
Условие задачи: Вычислите тепловой эффект реакции. Вычислите количество теплоты, которое выделяется (или поглощается), если в реакцию вступило m первого вещества:
| № задачи | Р е а к ц и я | m, г | Ответ: q, кДж |
C 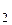 H H  OH(ж) + 3O OH(ж) + 3O 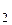 (г) = 2CO (г) = 2CO 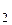 (г) + 3H (г) + 3H 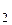 O(г) O(г) | -3087,2 | ||
CO 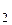 (г) + 4H (г) + 4H 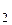 (г) = CH (г) = CH 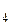 (г) + 2H (г) + 2H 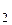 O(г) O(г) | -830 | ||
S(т) + 2CO 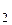 (г) = SO (г) = SO 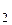 (г) + 2CO(г) (г) + 2CO(г) | 672,5 | ||
C 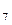 H H 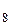 (ж) + SO (ж) + SO 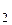 (г) = 7CO (г) = 7CO 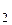 (г) + 4H (г) + 4H 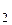 O(г) O(г) | 672,5 | ||
| C3H8 + 5O2 = 3CO2 + 4H2O(г) | –20439,3 |
Таблица 1 стандартные теплоты образования некоторых веществ
| Вещество | DНОБР кДж/моль | Вещество | DНОБР кДж/моль |
| Al2O3(Т) | -1675 | H2O(Ж) | -286 |
| Al2(SO4)3(Т) | -3434 | H2O(Г) | -242 |
| As2O3(Т) | -657 | H2S(Г) | -20 |
| CH4(Г) | -75 | MgO(Т) | -601 |
| C2H6(Г) | -85 | Mg(NO3)2 | -790 |
| C3H8(Г) | -104 | NH3(Г) | -425 |
| C6H6(Ж) | NO2(Г) | ||
| C7H8(Ж) | NaHCO3(Т) | -914 | |
| C2H5OH(Ж) | -278 | Na2CO3(Т) | -1129 |
| CO(Г) | -110 | Na2S(Т) | -372 |
| CO2(Г) | -393 | Na2SO3(Т) | -1090 |
| COS(Г) | -137 | Na2SO4(Т) | -1388 |
| HCl(Г) | -92 | PbO(Т) | -218 |
| HNO3(Ж) | -173 | PCl3(Г) | -277 |
| CuCl2(Т) | -220 | PCl5(Г) | -369 |
| CuO(Т) | -165 | POCl3(Ж) | -597 |
| Cu(NO3)2(Т) | -307 | SO2(Г) | -297 |
Таблица 2 Стандартные теплоты сгорания некоторых веществ
| Вещество | DHСГОР. кДж,моль | Вещество | DHСГОР. кДж,моль |
| H2 | -286 | C2H5OH | -1367 |
| CO | -283 | CH3COOH | -874 |
| CH4 | -890 | CH3COOC2H5 | -2254 |
| C2H2 | -1300 | N2O | -69 |
| C2H6 | -1560 | NH3 | -383 |
Задача 2 Направленность химических процессов, скорость и равновесие
На основании уравнения реакции дайте качественную оценку знака изменения энтропии и вычислите ее изменение по приведенным (под формулами) значениям энтропий участников реакции.
Вычислите величину изменения энергии Гиббса при стандартных условиях. В каком направлении протекает реакция при стандартной температуре? Как изменится положение равновесия реакции при повышении температуры? Вычислите значение изобарно-изотермического потенциала реакции при температурах 800, 900, 1000, 1100 и 1200К и постройте график DGХР = f(T). Проэкстраполируйте его на ТРАВН. Поясните его. По величине DG при 1000К укажите, будет ли КРАВН > 1.
Во сколько раз увеличатся скорость прямой и обратной реакции, если давление газовой смеси увеличить вдвое?
Запишите выражение для константы равновесия. Вычислите равновесные концентрации участников равновесия и константу равновесия, если концентрации исходных веществ были соответственно 1 и 2 моль/л, а к моменту наступления равновесия осталось 80% первого вещества. Вычислите температуру, при которой устанавливается химическое равновесие.
| № вар | ||||||
| CO(Г) | + H2(Г) | Á | C(ТВ) | + H2O(Г) | DH = -132 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| CO2(Г) | + 4H2(Г) | Á | CH4(Г) | +2H2O(Г) | DH = -254 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| 2SO2(Г) | + O2(Г) | Á | 2SO3(Г) | DH = -198 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| 2H2(Г) | + C(ТВ) | Á | CH4(Г) | DH = -75 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| CO2(Г) | + C(ТВ) | Á | 2CO(Г) | DH = +173 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| CH4(Г) | + H2O(Г) | Á | CO(Г) | + 3H2(Г) | DH = +207 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| 2CO(Г) | + 3Fe(ТВ) | Á | Fe3C(ТВ) | + СO2(Г) | DH = -149 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| CO(Г) | + FeO(ТВ) | Á | Fe(ТВ) | + CO2(Г) | DH = -17 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| 2H2(Г) | +GeO2(ТВ) | Á | Ge (ТВ) | + H2O(Г) | DH = +71 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| 4HCl (Г) | +GeO2(ТВ) | Á | GeCl4 (Г) | + 2H2O (Г) | DH = -56 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| 3CO(Г) | + 2Fe(ТВ) | Á | Fe2O3(ТВ) | + 3С(ТВ) | DH = -490 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| 3H2(Г) | +Fe2O3(ТВ) | Á | 2Fe(ТВ) | +3H2O(Г) | DH = +97 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| 4HCl (Г) | + O2(Г) | Á | 2Cl2(Г) | +2H2O(Г) | DH = -114 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| CH4(Г) | + CO2(Г) | Á | 2CO(Г) | + 2H2(Г) | DH = +247 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| CO(Г) | +Fe3O4(ТВ) | Á | 3FeO (ТВ) | + CO2(Г) | DH = 35 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| CO(Г) | + FeO(ТВ) | Á | Fe(ТВ) | + CO2(Г) | DH = -19,3 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| CO(Г) | + H2O(Г) | Á | CO2(Г) | + H2(Г) | DH = -41,2 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| H2O(Г) | + Fe(ТВ) | Á | FeO(ТВ) | + H2(Г) | DH = -21,9 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| 2NO(Г) | + O2(Г) | Á | 2NO2(Г) | DH = -112,9 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| 4NH3(Г) | + 3SO2(Г) | Á | 2N2(Г) | +3S(ТВ)+ 6H2O(Ж) | DH = -543,8 кДж/моль | |
| 32 70 | S0 = [Дж/моль·К] | |||||
| CO(Г) | + Cl2(Г) | Á | COCl2(Г) | DH = -13 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| SO2(Г) | + NO2(Г) | +H2O(Ж) | Á | NO(Г) + H2SO4(Ж) | DH = -174 кДж/моль | |
| 211 157 | S0 = [Дж/моль·К] | |||||
| H2(Г) | +HCOH(Г) | Á | CH3OH(Г) | DH = -85 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| Cl2(Г) | + 2NO(Г) | Á | 2NOCl(Г) | DH = -73 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| CH4(Г) | + 2H2S(Г) | Á | CS2(Г) | + 4H2(Г) | DH = +230 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| CH3CHO(Г) | + H2(Г) | Á | C2H5OH(Г) | DH = -70 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| С6H6(Г) | + 3H2(Г) | Á | C6H12(Г) | DH = -206 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| 3CO2(Г) | + 2H2O(Г) | Á | CH3OH(Г) | +2CO2(Г) | DH = -172 кДж/моль | |
| S0 = [Дж/моль·К] | ||||||
| PCl3(Г) | + Cl2(Г) | Á | PCl5(Г) | DH = -93 кДж/моль | ||
| S0 = [Дж/моль·К] | ||||||
| 3H2(Г) | + Sb2S3(Т) | Á | 3H2S(Г) | + 2Sb(Т) | DH = 89 кДж/моль | |
| S0 = [Дж/моль·К] |
