Механизм электрохимической коррозии
Главная страница ---> Конспект лекций по химии ---> Механизм электрохимической коррозии
Разрушение металлов в растворах электролитов это результат окислительно-восстановительного взаимодействия, которое слагается из анодного и катодного электродных процессов. Анодный процесс (окисление)— это переход металла в раствор в виде гидратированных ионов; при этом на поверхности металла остается эквивалентное число электронов:
Ме – ne → Men+
Катодный процесс — связывание появившихся в металле избыточных электронов атомами, ионами или молекулами электролита, которые называются деполяризаторами (D):
D + me → Dm+
Без деполяризации анодный процесс, т.е. растворение металла, прекратился бы, как только сформировался двойной электрический слой и установилось динамическое равновесие на поверхности раздела фаз.
Наличие электронной проводимости у металла и ионной проводимости у электролитов позволяет анодным и катодным процессам протекать раздельно на разных участках металла. При этом потенциал анодного участка всегда должен иметь более отрицательное значение по сравнению с потенциалом катодного участка.
Важнейшими деполяризаторами служат ионы водорода (в кислой среде) и растворенный кислород (в нейтральной и щелочной средах):
а) 2H+ + 2 e = H 2 (водородная деполяризация), φа0= 0 В
б) О2 +2Н2О + 4е= 4 OH- (кислородная деполяризация), φб0= -0,41 В (нейтральная среда)
В случае электрохимической коррозии на поверхности металла возникают гальванические микроэлементы, каждый из которых состоит из участков с различными электродными потенциалами. Электрохимическая неоднородность поверхности обусловлена рядом факторов: неравномерным распределением остаточных деформаций в металле после термической и механической обработки, структурной неоднородностью защитных пленок, но чаще всего химической и структурной неоднородностью за счет включений разного рода. Применительно к железу и стали такими включениями могут быть примеси (вкрапления) другого металла, например, медь, шлаки, зерна графита, оксиды железа и, наконец, углеродсодержащая фаза в виде цементита. В конечном итоге в металле возникает множество гальванических микроэлементов с электродами очень малых размеров.
Масштабы потерь от коррозии металлов очень велики. Поэтому борьба с коррозией является одной из важнейших технических проблем в народном хозяйстве. В настоящее время применяют различные способы защиты металлов от коррозии с учетом характера агрессивных сред и условий эксплуатации металлоконструкций. К наиболее важным из них относятся защита поверхности металлов покрытиями, протекторная защита и электрозащита, использование ингибиторов коррозии.
Защита поверхности металла покрытиями. Такие покрытия изолируют от агресссивной среды и могут быть металлическими и неметаллическими. В качестве металлических покрытий чаще всего применяют медь, олово, цинк, никель, хром, тантал, реже — серебро и золото. В зависимости от соотношения электродных потенциалов защищаемого и покрывающего металлов различают анодные и катодные покрытия. В соответствии со своим местом в (гальванической паре более электроотрицательные покрытия являются анодными. Они действуют даже в случае нарушения сплошности.
Например, оцинкованное железо, при нарушении покрытия и попадания на поврежденные участки влаги, образует гальванический элемент, с электродами из железа и цинка. Рассмотрим возможные реакции на его электродах:
1. Fe2+ + 2e → Fe0 φ10= -0,44 В
2. Zn2+ + 2e → Zn0 φ20= -0,76 В
Восстановительная реакция будет протекать на электроде с большим электродным потенциалом, а окислительная на электроде с меньшим электродным потенциалом. Следовательно, окисляться на аноде будет цинк. На катоде же пойдет процесс восстановления, но не ионов железа, которых в электролите нет, а, в зависимости от среды, ионов водорода или кислорода.
А: Zn0 - 2e → Zn2+
К: О2 +2Н2О + 4е = 4 OH- (кислородная деполяризация), φб0= - 0,41 В
Возникший гальванический элемент можно записать следующим образом:
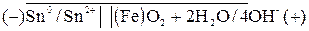
Покрытия, электродный потенциал которых более положителен, чем потенциал защищаемого металла, называются катодными. Они предохраняют изделие до тех пор, пока покрытие остается целостным. Например, в луженом железе анодом служит железо ( -0,44В), а катодом —слой олова
Sn2+/Sn= -0,14 В). Даже незначительное разрушение слоя приводит к быстрому развитию коррозии железа. В этих условиях олово не только не предохраняет от коррозии, а напротив, интенсифицирует ее. Однако достоинством луженых изделий является возможность применения их в пищевой, промышленности. Соединения олова не ядовиты в отличие от весьма токсичных соединений цинка и свинца. Поэтому металлические консервные банки изготавливают исключительно из луженой жести.
Для защиты сельскохозяйственной техники, ирригационного оборудования, насосных станций и гидротехнических сооружений от атмосферной коррозии применяют лаки и краски. Широко используют и другие неметаллические покрытия: эмали, смазки, масла, воск, битум, различного рода полимеры (полиэтилен, полистирол, полиамиды, фторопласты, эпоксидные смолы). Последние весьма эффективны для защиты деталей машин, работающих в контакте с особо агрессивными средами, например, машин для химической обработки растений гербицидами, туковысевающих аппаратов, машин для внесения жидких комплексных удобрений или мелиорантов.
Многослойные битумные покрытия надежно предохраняют подводные и подземные сооружения, включая водоводы и водопроводные сети, от воздействия речной воды, почвенных или грунтовых вод.
Протекторная защита и электрозащита. Это — электрохимические приемы защиты, основанные на том, что защищаемая конструкция становится катодным участком гальванической системы.
В случае протекторной защиты анодом (протектором) служит более активный металл или сплав (например, цинк, магний или их сплавы) с более отрицательным электродным потенциалом, чем потенциал металла защищаемой конструкции. Соединенные электрическим проводником с конструкцией протекторы в процессе эксплуатации разрушаются, предохраняя последнюю от коррозии. Эффективность протекторной защиты зависит от способов размещения протекторов и их размеров.
Катодная защитаотличается от протекторной тем, что защищаемую конструкцию искусственно делают катодом, присоединяя ее к внешнему источнику тока. В каждом отдельном случае подбирают и постоянно поддерживают оптимальное напряжение.
Описанные способы применяют для защиты от коррозии подземных водопроводных сетей, а также гидротехнических металлоконструкций (затворов, шлюзовых ворот, водоводов, сороудерживающих решеток и др.).
Для замедления коррозии металла в среду вводят вещества, называемые ингибиторами коррозии. Защитное действие этих веществ связано либо с окислением поверхности металлов (хроматы, нитриты), либо с образованием пленки труднорастворимого продукта (фосфаты), либо с адсорбционными явлениями). При этом ингибиторы чаще всего изменяют потенциал металла (пассивируют его) в растворе электролита, приближая его к потенциалу малоактивных металлов. Ингибиторы коррозии используются при хранении и перевозке минеральных кислот, при консервации сезонно эксплуатируемых дождевальных агрегатов, комплектов ирригационного оборудования, сельскохозяйственной техники.
Ингибиторы коррозии – вещества, которые, находясь в коррозионной среде в достаточной концентрации, сильно замедляют либо вообще прекращают коррозионное разрушение металла . Ингибитором коррозии может быть как одно соединение, так и смесь нескольких.
Эффективность действия ингибиторов коррозии можно оценить по двум показателям: степени защиты (Z, %) и коэффициенту торможения коррозии γ (защитный эффект ингибитора).
Классификация ингибиторов коррозии по механизму действия:
- пассивирующие ингибиторы;
- адсорбционные ингибиторы.
