Тема 4. Химическая кинетика
Кинетика химических реакций – это учение о скорости химических процессов.
Скоростью химической реакции называют изменение концентрации какого-либо из реагирующих веществ в единицу времени.
Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса, а именно: концентрации реагирующих веществ, температуры, наличия катализаторов и др.
Зависимость скорости реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях , равных стехиометрическим коэффициентам. Например, для реакции
2NO + O2 → 2NO2 закон действия масс может быть записан
v = k [NO]2[O2],
где v – скорость химической реакции,
k – константа скорости,
[NO], [O2] – концентрации реагирующих веществ.
Реакция в гетерогенной системе, где реагирующие вещества находятся в разных фазах, осуществляется на поверхности раздела между фазами. Поэтому скорость гетерогенной реакции при постоянной температуре зависит от площади поверхности раздела, а не от концентрации твердого вещества. В этом случае для реакции
С (тв) + О2 → СО2 (г)
Закон действия масс может быть записан
v = k [O2]
Пример 1. Как изменится скорость реакции N2+3H2 →2NH3 при увеличении давления в системе в 2 раза?
Так как исходные вещества газообразные, то изменение давления и объема влияют на концентрации этих веществ: увеличение давления пропорционально концентрации этих веществ, а увеличение объема, наоборот, уменьшает концентрацию этих веществ.
Запишем выражение закона действия масс для данной реакции:
v1= k [N2][H2]3,
При увеличении давления в два раза концентрация обоих реагирующих веществ также увеличится в два раза. Тогда
v2 = k [2N2][2H2]3
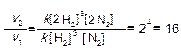
Следовательно, скорость реакции увеличится в 16 раз.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
vt2 = vt1∙γ(t2-t1)/10 , где
vt2 и vt1 скорости реакций при t1 и t2;
γ – температурный коэффициент, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на 10°, может принимать значения от 2 до 4.
Причиной роста скорости реакции от температуры является увеличение доли молекул, имеющих энергию активации, т. е. долю активных молекул. Энергия активации это та энергия, которая необходима чтобы произошла химическая реакция, она всегда больше чем средняя энергия молекул данной системы.
Пример 2. Как изменится скорость реакции при повышении температуры реакции с 25° до 75°, если температурный коэффициент равен 2?
vt2/ vt1 = γ(t2-t1)/10 = 2(75-25)/10 = 25 = 32
Скорость реакции возрастет в 32 раза.
Скорость химической реакции возрастает в присутствии катализатора, который снижает энергию активации, благодаря образованию нестабильных промежуточных соединений.
Контрольные вопросы
- Как следует изменить температуру, чтобы скорость реакции возрасла в 100 раз, если температурный коэффициент равен 2?
- Как изменится скорость реакции 2NO + O2 = 2NO2 при уменьшении давления в 3 раза?
- Как изменится скорость реакции при изменении температуры с 70° до 30° С если
γ = 3? - Как следует изменить давление, чтобы увеличить скорость реакции
С2Н4 + Н2 = С2Н6 в 30 раз?
