Основание в теории Бренстеда — Лоури
В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Й. Бренстедом и английским учёным Т. Лоури, основанием Бренстеда называется соединение или ион, способный принимать (отщеплять) протон от кислоты[6]. Соответственно, кислота Брёнстеда является донором протонов, а взаимодействие кислоты с основанием сводится к передаче протона. При реакции основания Брёнстеда B с кислотой, например, с водой, основание превращается в сопряжённую кислоту BH+, а кислота становится сопряжённым основанием[4]:
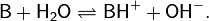
Теории кислот и оснований — совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований — двух классов веществ, реагирующих между собой. Задача теории — предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания.


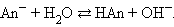



На практике из соображений удобства вместо величин Ка и Кb очень часто пользуются логарифмическими показателями констант, а именно: рКа = – lgKa , pKb = – lgKb . Чем сильнее данная кислота, тем больше ее константа кислотности Ка и меньше величина рКа .
5. Автопротолиз — гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов.
Наиболее важное значение имеет автопротолиз воды. Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как 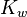 . Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
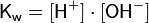
При стандартных условиях ионное произведение воды равно 10−14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.
Водоро́дный показа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, выраженной в молях на один литр:
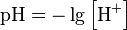
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
6. Ко́мплексные соединения или координационные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Факторы, влияющие на комплексообразование: строение центрального атома и лиганда, концентрация компонентов, рН, ионная сила раствора, температура. Классификация комплексных соединений по термодинамической и кинетической устойчивости.
Константа устойчивости служит количественной характеристикой прочности комплексного соединения в растворе – чем больше константа устойчивости, тем прочнее комплекс и тем полнее связаны (закомплексованы) ионы металла.
Прочность комплексных соединений можно характеризовать также с помощью констант нестойкости, которые соответствуют процессу диссоциации комплексной частицы в растворе.
7. Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
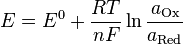
, где
 — электродный потенциал,
— электродный потенциал, 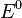 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
·  — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
·  — абсолютная температура;
— абсолютная температура;
·  — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
· 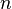 — число электронов, участвующих в процессе;
— число электронов, участвующих в процессе;
· 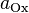 и
и 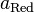 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Стандартный потенциал – термодинамическая стандартизованная величина – является очень важным физико-химическим и аналитическим параметром, позволяющим оценить направление соответствующей реакции и рассчитывать активности реагирующих частиц в условиях равновесия.
Потенциал любой окислительно-восстановительной системы, измеренный в стандартных условиях относительно водородного электрода, называют стандартным потенциалом (Е°) этой системы.
Стандартный потенциал окислительно – восстановительной системы принято считать положительным, если она выступает в качествеокислителя,а на водородном электроде протекает полуреакция окисления
Н2 – 2е- → 2Н+,
или отрицательным, если система играет роль восстановителя, а на водородном электроде происходит полуреакция восстановления
2Н+ + 2е- → Н2.
Значение стандартного потенциала характеризует «силу» окислителя или восстановителя.
При увеличении рН раствора, то есть при уменьшении концентрации ионов водорода равновесие (35) смещается в сторону прямой реакции, что влечет за собой снижение концентрации ионов Fe3+ в результате их превращения в гидроксокатионы FeOH2+. Это, в свою очередь, влияет на величину окислительно-восстановительного потенциала: дробь под знаком логарифма в выражении (34) уменьшается и, следовательно, уменьшается потенциал рассматриваемой окислительно-восстановительной пары. Иными словами, окислительные свойства катиона Fe3+ с увеличением рН раствора ослабевают, а восстановительные свойства Fe2+ усиливаются.
9. Для определения направления ОВР нужно рассчитать ЭДС = Е (Окислителя) - Е (Восстановителя) : если ЭДС больше 0, реакция идет в прямом направлении, если ЭДС меньше 0 - в обратном, если равна 0 - не возможна.
Для обратимого гальванического элемента изменение стандартного изобарно-изотермического потенциала можно рассчитать по формуле:
DG = - zF × E0 (3.23.)
где z - число электронов, участвующих в реакции;
F - постоянная Фарадея;
Е0- стандартная э.д.с., т.е. разность стандартных электродных потенциалов.
С другой стороны, мы помним, что величина DG0 связана с константой равновесия уравнением изотермы:
DG0 = -RT ln Kc
Отсюда следует,
zF E0 = RT ln Kc, или
lnKc = zF E0/RT; lgKc= E0 z / 0,059 (3.24.)
Таким образом, определив с помощью таблицы или измерив величину стандартной э.д.с., можно рассчитать константу равновесия.
10. ПР (произведение растворимости) - это величина, представляющая собой произведение концентраций ионов труднорастворимого электролита в растворе. Эта величина характеризует растворимость данного вещества: чем больше растворимость, тем больше концентрация ионов и, следовательно, ПР.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:

где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Осадок малорастворимого электролита образуется только тогда, когда ионное произведение (ИП) превысит при данной температуре величину его произведения растворимости.
Если ИП < ПР – р-р ненасыщенный;
ИП = ПР – р-р насыщенный;
ИП > ПР – р-р пересыщенный;
ИП ПР↓ – условие образования осадков.
ПК = с (^+)п с (Ап-)т > ПРкпАт,
где ПК - произведение концентраций ионов, находящихся в данном растворе.
о величине ПР может быть найдена растворимость вещества s (моль/л) . Для бинарных электролитов, например, BaS04 (ПР = 1,1 *10-10),
2+ 2-
растворимость s = с (Ва ) = c(SO4 ), поэтому
ПР = с (Ва2+) • c(SO42-) = s2, откуда s = VIP = Л/1,1-10"10 = 10"5 моль/л.
11. фото
12. 12.
