Vi. окислительно-восстановительные реакции
Степень окисления атома. Окислительно-восстановительные свойства атомов элементов и химических соединений. Окислители, восстановители и их эквиваленты. Составление уравнений окислительно-восстановительных реакций. Окислительно-восстановительный потенциал и направление протекания химических реакций.
1. Степень окисления атома марганца в перманганате калия равна … .
1) +6 2) +4 3) +7 4) –7
2. Степень окисления атома азота в азотистой кислоте равна … .
1) –3 2) +3 3) +5 4) +4
3. Степени окисления атомов марганца в КМnО4, К2МnО4, МnО, МnО2 соответственно равны … .
1) +4, +2, +6, +7 2) +7, +6, +4, +2
3) +6, +2, +4, +7 4) +7, +6, +2, +4
4. Степени окисления атомов хрома в К2СrО4, К2Сr2О7, Сr2(SО4)3 соответственно равны … .
1) +3, +6, +3 2) +3, +3, +6
3) +6, +6, +3 4) +3, +6, +6
5. Высшая и низшая степени окисления атома хлора соответственно равны … .
1) +5 и 0 2) +7 и 0 3) +7 и –3 4) +7 и –1
6. Только окислительные свойства проявляет … .
1) НСl 2) НСlО4 3) Сl2 4) НСlО
7. Сера проявляет свойства окислителя в реакции … .
1) S + Fе → 2) S + Сl2 →
3) S + НNО3 → 4) S + О2 →
8. Свойства и окислителя и восстановителя атом азота может проявлять в … .
1) NН3 и НNО2 2) НNО3 и НNО2
3) NО и NН3 4) NО и НNО2
9. Если свойства иона водорода не учитывать, то свойства и окислителя и восстановителя может проявлять … .
1) сернистая кислота 2) азотная кислота
3) серная кислота 4) сероводородная кислота
10. Процесс окисления описывается схемой … .
1) 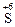 →
→ 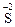 2)
2) 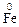 →
→ 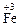
3) 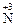 →
→ 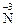 4)
4) 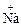 →
→ 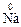
11. Процессы окисления описываются схемами:
1) 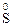 →
→ 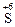 и
и 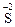 →
→ 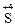 2)
2) 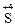 →
→ 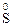 и
и 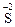 →
→ 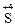
3) 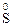 →
→ 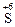 и
и 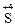 →
→ 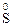 4)
4) 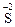 →
→ 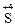 и
и 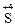 →
→ 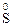
12. Процессы восстановления описываются схемами:
1) 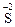 →
→ 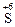 и
и 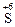 →
→ 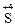 2)
2) 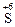 →
→ 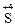 и
и 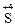 →
→ 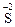
3) 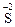 →
→ 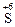 и
и 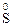 →
→ 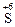 4)
4) 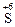 →
→ 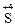 и
и 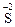 →
→ 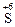
13. Процесс восстановления описывается схемой … .
1) 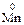 →
→ 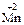 2)
2) 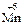 →
→ 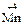
3) 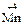 →
→ 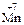 4)
4) 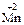 →
→ 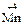
14. Окислительно-восстановительные реакции в растворах могут протекать между … .
1) КМnО4 и Н2S 2) КМnО4 и Н2SО4
3) КМnО4 и Н2SО3 4) КМnО4 и НNО3
15. Окислительно-восстановительные реакции в растворах могут протекать между … .
1) НNО3 и Н2SО3 2) НNО3 и Н2SО4
3) НNО3 и Н2S 4) НNО3 и КМnО4
16. В результате взаимодействия НNО2 и Н2S можно получить … .
1) NО 2) NО2
3) NО и NО2 4) НNО3
17. При взаимодействии КМnО4 и НNО2 можно получить … .
1) NО 2) НNО3
3) NО и НNО3 4) NО и NО2
18. Стехиометрический коэффициент перед формулой нитрата серебра в уравнении реакции
Аg + НNО3 → АgNО3 + NО2 + Н2О
равен … .
1) 1 2) 2 3) 3 4) 4
19. Стехиометрический коэффициент перед формулой окислителя в уравнении реакции
КI + Сu(NО3)2 → СuI + I2 + КNО3
равен … .
1) 2 2) 4 3) 1 4) 3
20. Стехиометрический коэффициент перед формулой окислителя в уравнении реакции
МnО2 + КСlО3 + КОН → К2МnО4 + НСl + Н2О
равен … .
1) 1 2) 2 3) 3 4) 4
21. Стехиометрический коэффициент перед формулой восстановителя в уравнении реакции
NаСrО2 + Вr2 + NаОН → Nа2СrО4 + NаВr + Н2О
равен ... .
1) 3 2) 8 3) 2 4) 6
22. Стехиометрический коэффициент перед формулой восстановителя в уравнении реакции
КI + КNО2 + Н2SО4 → NО + I2 + К2SО4 + Н2О
равен ... .
1) 1 2) 2 3) 3 4) 4
23. Сумма стехиометрических коэффициентов в уравнении реакции
МnО2 + КВr + Н2SО4 → МnSО4 + К2SО4 + Вr2 + Н2О
равна … .
1) 4 2) 6 3) 8 4) 10
24. Сумма стехиометрических коэффициентов в уравнении реакции
РbО2 + НСl → РbСl2 + Сl2 + Н2О
равна … .
1) 9 2) 8 3) 12 4) 6
25. Молекулярным кислородом можно окислить … .
1) Ni и Аu 2) Аu 3) Ni
Ni2+ + 2е– = Ni Е0 = – 0,25 В
Аu3+ + 3е– = Аu Е0 = +1,50 В
О2 + 4Н+ + 4е– = 2Н2О Е0 = +1,23 В
26. Молекулярным кислородом можно окислить … .
1) Мg 2) Аu 3) Мg и Аu
Мg2+ + 2е– = Мg Е0 = –2,36 В
Аu3+ + 3е– = Аu Е0 = +1,50 В
О2 + 4Н+ + 4е– = 2Н2О Е0 = +1,23 В
27. Реакция 2НIО3 + 5SО2 + 4Н2О 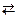 I2 + 5Н2SО4
I2 + 5Н2SО4
(2IО3– + 12Н+ + 10е– = I2 + 6Н2О, Е0 = +1,20 В;
SО42– + 4Н+ + 2е– = SО2 + 2Н2О, Е0 = +0,14 В)
самопроизвольно протекает в … .
1) направлении справа налево
2) направлении слева направо
3) обоих направлениях
28. Реакция Н2S + 2НNО3 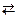 S + 2NО2 + 2Н2О
S + 2NО2 + 2Н2О
(NО3– + 2Н+ + е– = NО2 + Н2О, Е0 = +0,80 В;
S + 2Н+ + 2е– = Н2S, Е0 = +0,17 В)
самопроизвольно протекает в … .
1) прямом направлении
2) обратном направлении
3) обоих направлениях
29. Реакция РbСl2 + Сl2 + 2Н2О 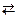 РbО2 + 4НСl
РbО2 + 4НСl
(Сl2 + 2е– = 2Сl–, Е0 = +1,35 В;
РbО2 + 4Н+ + 2е– = Рb+2 + 2Н2О, Е0 = +1,45 В)
самопроизвольно протекает в … .
1) прямом направлении
2) обратном направлении
3) обоих направлениях
30. Реакция Zn + КNО3 + 2КОН 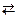 К2ZnО2 + КNО2 + Н2О
К2ZnО2 + КNО2 + Н2О
(ZnО22– + 2Н2О + 2е– = Zn0 + 4ОН–, Е0 = –1,22 В;
NО3– + Н2О + 2е– = NО2– + 2ОН–, Е0 = +0,01 В)
самопроизвольно протекает в … .
1) прямом направлении
2) обоих направлениях
3) обратном направлении
