Химическая символика классификация неорганических соединений
2.1. Химическая символика
Любой химический символ имеет двойной смысл: 1) обозначает атом или молекулу; 2) обозначает атомную или молекулярную массу. Поэтому из химической формулы и из химического уравнения вытекает два вывода: качественный и количественный.
В химии принято атом (химический элемент) обозначать химическим знаком, молекулу – химической формулой, схему химического превращения одних веществ в другие – уравнения химических реакций.
Химический знак – обозначают первыми (одной или двумя) буквами латинского названия элемента.
П р и м е р: H – Hydrogenium – водород, N – Nytrogenium – азот, Au – Aurum – золото.
Известно более 120 химических элементов. Каждый элемент имеет знак и место в таблице – «клетку». «Клетка» имеет свой номер и, кроме того, соответствует определенному номеру вертикального столбца – группы и номеру горизонтального периода
Классификация неорганических соединений по функциональным признакам и составу.
Химические вещества (по составу)
 |  |


 Простые Сложные
Простые Сложные
металлы бинарные трехатомные
неметаллы
амфотерные элмененты
Al, Zn
Количество атомов в составе сложной молекулы указываются индексами (единица не записывается в составе молекулы)
LiH - 1 атом лития, 1 атом водорода
SO3 – 1 атом серы, 3 атома кислорода
Если в молекуле имеются скобки, то количество атомов увеличивается.
Al2(SO4)3 – 2 атома алюминия, 2 атома серы, 12 атомов кислорода.
Значения индексов зависят от валентности элементов и групп, входящих в состав молекулы.
Классификация сложных неорганических веществ по составу:
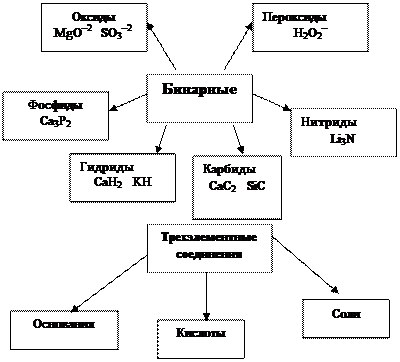 |
2. Оксиды. Классификация. Свойства. Получение.
Оксиды – сложные вещества, состоящие из двух элементов один из которых кислород (Валентность -II, степень окисления -2).
H2O H-O-H
+H : O-2 : H+
Существуют солеобразующие и несолеобразующие оксиды.
Номенклатура оксидов
Слово “оксид” + “название элемента” + валентность
SO2 - оксид серы (IV) - (SIVO2II)
К несолеобразующим оксидам относят оксиды, которые не образуют солей (CO, NO).
Существуют 3 группы оксидов:
- основные
-кислотные
-амфотерные
Основные
К основным оксидам относят оксиды типичных металлов.
Получение
1) Окисление металлов (кроме металлов1-А гр.)
2Са+О2 → 2СаО
2) Обжиг сульфидов
FeS + O2 →t Fe2O3 + SO2
основной и кислотный оксиды
3) Разложение гидроксидов тяжелых металлов
Cu (OH)2 →t CuO + H2O
основной и амфотерный оксид
4) Разложение солей (особенно карбонатов и нитратов)
CaCO3 –t CaO+CO2↑
Химические свойства
1.Основные оксиды взаимодействуют с кислотными оксидами
BaO+SiO2 → BaSiO3
2.Взаимодействуют с амфотерными оксидами
MgO+Al2O3 → Mg(AlO2)2
3.Взаимодействуют с кислотами
CaO+H2SO4 → CaSO4+H2O
4.Взаимодействуют с водой
CaO+H2O →Ca(OH)2
5.Участвуют в ОВР
Fe+32O-23+Al0 → Al+32O-2+Fe0
Кислотные
Кислотные оксиды – оксиды неметаллов или переходных металлов в высшей степени валентности
Mn+2 Mn+4 Mn+7
основной амфотерный кислотный
Способы получения
а)окисление неметаллов
С+О2 → t СО2
б)смотри способы 2 и 4
Номенклатура
Наряду с современной номенклатурой для кислотных оксидов используется старинная система названий ангидридов кислот.
Ангидрид – продукт отщепления воды от соответствующей кислоты
Химические свойства
1.кислотные оксиды взаимодействуют с водой и образованиями кислот
SO3+H2O →H2SO4
2.взаимодействуют с амфотерными оксидами
P2O5+Al2O3 → 2AlPO4
3.взаимодействуют с основаниями
CO2+Ca(OH)2 →CaCO3+H2O
4.участвуют в ОВР
2SO2+O2 → t 2SO3
Амфотерные
Амфотерные оксиды сочетают свойства основных и кислотных оксидов.
Al2O3+6HCl →2AlCl3+3H2O
Al2O3+NaOH+H2O → Na[Al(OH)4]
H2O – идеальный амфотерный оксид
