Определение координационного числа комплексообразователя в роданидном комплексе железа (III)
Как было показано в предыдущей главе (гл. 3.1), конкурирующая реакция образования нерастворимого гидроксида меди не позволила определить координационное число металла в его комплексе с аммиаком. Поэтому в качестве второго соединения для изучения координационного числа иона металла был выбран комплексный роданид железа (III), образование которого в растворе протекает в нейтральной среде и не сопровождается реакцией образования нерастворимого гидроксида.
Реакция образования роданида железа (III) – одна из качественных реакций на ионы Fe3+ , приводящая к образованию комплекса интенсивной кроваво-красной окраски. При этом образуется координационное соединение [Fe(SCN)6]3+, комплексный ион имеет конфигурацию октаэдра с sp3d2-гибридизацией центрального атома.
Таблица 2 – Оптические плотности D растворов изомолярной серии комплексообразователя Fe3+ и лиганда SCN-
| № | V(p-pa Fe3+), мл | V(p-pa SCN-), мл | n(Fe3+) : n(SCN-) | D |
| 10 : 0 | 0.013 | |||
| 9 : 1 | 0.245 | |||
| 8 : 2 | 0.461 | |||
| 7 : 3 | 0.640 | |||
| 6 : 4 | 0.700 | |||
| 5 : 5 | 0.706 | |||
| 4 : 6 | 0.696 | |||
| 3 : 7 | 0.526 | |||
| 2 : 8 | 0.407 | |||
| 1 : 9 | 0.176 | |||
| 0 : 10 | 0.000 |
С целью проверки возможности лабораторного подтверждения указанного факта о координационном числе иона железа в данном комплексе был применен метода изомолярных серий, для чего были приготовлены растворы с разным соотношением n(Fe3+) : n(SCN-) при постоянном суммарной концентрации комплексообразователя и лиганда (см. гл. 2.4 и табл. 2).
Как и ожидалось, в полученных растворах появилась интенсивная кроваво-красная окраска (см. фотографию 1 приложения А). График зависимости оптических плотностей D растворов данной изомолярной серии от относительного количества комплексообразователя (рис. 5) практически соответствует теоретическому, однако не для соотношения M : L равном 1 : 6 (комплекс состава ML6), а соотношения M : L близкого к 1 : 1.
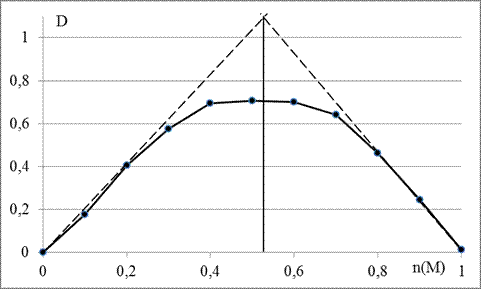
Рисунок 5 – График зависимости оптических плотностей D растворов изомолярной серии комплексообразователя Fe3+ и лиганда SCN- от относительного количества комплексообразователя n(M)
Ступенчатый процесс комплексообразования иона Fe3+ с роданид-ионом описывается уравнениями:
Fe3+ + SCN- ↔ [Fe(SCN)]2+
[Fe(SCN)]2+ + SCN- ↔ [Fe(SCN)2]+
[Fe(SCN)2]+ + SCN- ↔ [Fe(SCN)3]0
[Fe(SCN)3]0 + SCN- ↔ [Fe(SCN)4]-
[Fe(SCN)4]- + SCN- ↔ [Fe(SCN)52-
[Fe(SCN)5]2- + SCN- ↔ [Fe(SCN)6]3-
Формально получается, что согласно методу изомолярных серий точке эквивалентности приблизительно соответствует комплекс с координационным числом железа, равным 1 – [Fe(SCN)]2+. Однако это противоречит устоявшемуся утверждению, что координационное число железа (III) в его координационных соединениях обычно равно 6.
Кажущееся противоречие легко устраняется, если вспомнить, что исходный хлорид железа в водном растворе представляет собой гексагидрад FeCl3×6H2O, формулу которого правильно записывать в виде координационного соединения [Fe(H2O)6]Cl3.
Тогда, ступенчатый процесс комплексообразования иона Fe3+ с роданид-ионом в водном растворе описывается уравнениями:
[Fe(H2O)6]3+ + SCN- ↔ [Fe(SCN)(H2O)5]2+ + H2O
[Fe(SCN)(H2O)5]2+ + SCN- ↔ [Fe(SCN)2(H2O)4]+ + H2O
[Fe(SCN)2(H2O)4]+ + SCN- ↔ [Fe(SCN)3(H2O)]0 + H2O
[Fe(SCN)3(H2O)3]0 + SCN- ↔ [Fe(SCN)4(H2O)2]- + H2O
[Fe(SCN)4(H2O)2]- + SCN- ↔ [Fe(SCN)5H2O]2- + H2O
[Fe(SCN)5H2O]2- + SCN- ↔ [Fe(SCN)6]3- + H2O
При этом к.ч. иона железа в получаемом (в соответствии с методом изомолярных серий) координационном ионе Fe(SCN)(H2O)5]2+ равно 6, однако к.ч. относительно роданид-иона равно только 1.
Основная причина того, что метод изомолярных серий дает результат, существенно отличающийся от стандартно приводимых в книгах реакций (записываемых в молекулярном виде):
FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl
FeCl3 + 6KSCN = K3[Fe(SCN)6] + 3KCl
по-видимому, заключается в том, что метод изомолярных серий [1, 8] дает абсолютно корректные результаты только в случае образования только одного координационного соединения. В данном же случае происходит одновременное образование 6 координационных соединений, содержащих роданид-ионы и имеющих кроваво-красную окраску.
Метод насыщения (см. гл. 1.3.1) такого ограничения не имеет. Поэтому была проведена попытка определения координационного числа иона железа (III) в роданидном комплексе этим методом (см. гл. 2.5, табл. 3, фотография 2 приложения).
Таблица 2 – Оптические плотности D растворов комплексообразователя Fe3+ и лиганда SCN- метода насыщения
| № | V(p-pa Fe3+), мл | V(p-pa SCN-), мл | n(Fe3+) : n(SCN-) | D |
| 2 : 1 | 0.091 | |||
| 1 : 1 | 0.165 | |||
| 1 : 2 | 0.280 | |||
| 1 : 4 | 0.470 | |||
| 1 : 8 | 0.650 | |||
| 1 : 16 | 0.875 | |||
| 1 : 32 | 1.035 | |||
| 1 : 49 | 1.160 |
Точка эквивалентности на графике зависимости оптических плотностей растворов от соотношения количеств лиганда SCN- и комплексообразователя Fe3+ (рис. 5) практически идеально равно 6 и однозначно подтверждает, что при существенном избытке роданид-иона в растворе комплексообразование протекает по уравнению:
FeCl3 + 6KSCN = K3[Fe(SCN)6] + 3KCl
или в ионном виде:
[Fe(H2O)6]3+ + 6SCN- ↔ [Fe(SCN)6]3- + 6H2O
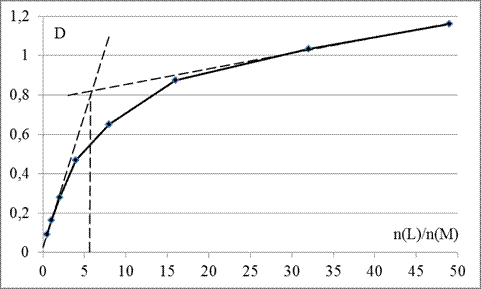
Рисунок 5 – График зависимости оптических плотностей D растворов, содержащих лиганд SCN- и комплексообразователи Fe3+ от отношения их количеств n(L)/n(M) (метод насыщения)
Выводы
1. Оборудование школьной лаборатории "Муниципальное казенное общеобразовательное учреждение "Средняя общеобразовательная школа" с. Владимиро-Александровское", приобретенное за счет средств ЗАО "Восточная нефтехимическая компания" позволяет проводить исследование процессов комплексообразования в водных растворах.
2. Метод изомолярных серий определения координационного числа комплексообразователя в окрашенных координационных соединений имеет ряд существенных ограничений, таких как малое координационное число иона металла и образование только одного устойчивого координационного соединения, что не позволило корректно определить координационное число в роданидном комплексе железа (III), а также отсутствие конкурирующих реакций образования нерастворимых гидроксидов, что не позволило корректно определить координационное число в аммиачном комплексе меди (II).
3. Методом насыщения подтверждено координационное число железа (III) в его роданидном комплексе, равное 6, что соответствует правильному написанию уравнения реакции образования кроваво-красной окраски в качественной реакции определения ионов Fe3+ в растворах в виде:
FeCl3 + 6KSCN = K3[Fe(SCN)6] + 3KCl
Список литературы
1 Алакаева, Л. А. Люминесцентные методы исследования комплексных соединений : Учебное пособие. / Л. А. Алакаева, Р. Д. Ульбашева. – Нальчик : Каб-Балк. ун-т, 2003. – 58 с.
2 Ашуйко, В. А. Химия комплексных соединений : курс лекций для студентов специальностей 1-48 01 02 «Химическая технология органических веществ, материалов и изделий», 1-48 01 05 «Химическая технология переработки древесины», 1-48 02 01 «Биотехнология», 1-57 01 03 «Биоэкология» / В. А. Ашуйко. – Минск : БГТУ, 2011. – 130 с.
3 Введение в химию координационных соединений [Электронный ресурс]. – Режим доступа : http://www.isuct.ru/dept/vhk/Russian/Materials/UMK/Coordination_Chemistry/Doc/Coord_Chem_1.pdf, свободный. – Загл. с экрана.
4 Киселев, Ю. М. Химия координационных соединений : учеб. пособие для студ. высш. проф. учеб. заведений / Ю. М. Киселев, Н. А. Добрынина. – М. : Академия, 2007. – 352 с.
5 Кузьменко, Н. Е. Начала химии. Современный курс для поступающих в вузы : учебник : 15-е изд., стереотип. / Н. Е. Кузьменко, В. В. Еремин, В. А. Попков. – М.: Экзамен, 2010. – 831 с.
6 Кукушкин, Ю. Н. Химия координационных соединений : Учебное пособие для студентов хим. и хим.-технол. спец. Вузов / Ю. Н. Кукушкин. – М. : Высш. шк., 1985. – 455 с.
7 Лурье, Ю. Ю. Справочник по аналитической химии : изд. 4-ое, перераб. и доп. / Ю. Ю. Лурье. – М. : Химия, 1971. – 456 с.
8 Практикум по неорганической химии / под ред. А. Ф. Воробьева, С. И. Дракина. – М. : Химия, 1984. – 248 с.
9 Татаринова, Э. С. Химия координационных соединений : Презентация –Наглядное пособие [Электронный ресурс] / Э. С. Татаринова, Е. В. Черкасова. – Кемерово : ГУ КузГТУ, 2010. – Режим доступа : http://www.twirpx.com/file/963699/, свободный.
10 Химическая энциклопедия. Т. 2 / Гл. ред. И. Л. Кнунянц. – М. : Советская энциклопедия, 1990. – С. 467-472.
Приложение А
Фотографии серии растворов, приготовленных для определения координационного числа железа (III) в его роданидном комплексе

Рисунок А.1 – Фотография серии растворов для определения координационного числа иона Fe3+ в его комплексе с роданид-ионом методом изомолярных серий

Рисунок А.2 – Фотография серии растворов для определения координационного числа иона Fe3+ в его комплексе с роданид-ионом методом насыщения
