На смещение положения химического равновесия
Лабораторная работа №
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цель работы:
Теория(оформляется с использованием: Лабораторного практикума по курсу химии для технических университетов, МГТУ,2005, ч.1, стр.89-97 , конспекта лекций, учебников: А.А.Гуров. Химия. стр.360-377, Н.В.Коровин.Общая химия, стр.142-152)
1. Дайте определение химическому равновесию:
2. Дайте определение кинетически обратимым реакциям:
3. Укажите условие химического равновесия:
4. Дайте определение подвижности химического равновесия:
5. Дайте определение динамическому характеру химического равновесия:
6. Дайте определение кинетическому выражению закона действующих масс:
7. Дайте определения константе равновесия их закона действующих масс (в условиях наступления химического равновесия):
8. Приведите уравнение обратимой гомогенной реакции в общем воде:
9. Приведите выражения констант равновесия Кс, Кр, Кх (8.1) лаб.практикума):
10. Приведите формулы, отражающие взаимосвязь между константами: Кр и Кс, Кр и Кх (8.2) лаб.практикума):
11. Приведите формулу для расчета алгебраической суммы стехиометрических коэффициентов (∆ν):
12. Укажите условия, при которых Кс = Кр = Кх:
13. Приведите формулу для расчета термодинамической константы равновесия:
14. Приведите определение принципа Ле-Шателье (А.А.Гуров. Химия. стр.361-377, Н.В.Коровин. Общая химия стр.146-147):
15. Приведите определения трех выводов из принципа Ле-Шателье, касающихся смещения химического равновесия в системе при повышении температуры(А.А.Гуров. Химия. стр.361), давления (А.А.Гуров. Химия. стр.364) и концентрации веществ (А.А.Гуров. Химия. стр.369, Н.В.Коровин.Общая химия стр.146-147):
16. Напишите выражения для констант равновесия обратимых химических реакций: а) CO(г) + CI2(г) ↔ COCI2(г)
б) N2(г) + 3H2(г) ↔ 2NH3(г)
в) FeO(тв.) + CO(г) ↔ Fe(тв.) + CO2(г)
Практическая часть
Опыт 1. Влияние посторонних веществ и изменения концентраций компонентов
на смещение положения химического равновесия
Реагенты: FeCl3, NH4NCS
Уравнение реакции (лабораторный практикум, стр. 92):
FeCl3(р) + 3NH4NCS(р) D
Добавляемые вещества: FeCl3 (реагент), NH4NCS (реагент), NH4Cl (продукт реакции), Н2С2О4 (постороннее вещество)
Уравнение, описывающее влияние посторонних веществ на положение равновесия изучаемой реакции (лабораторный практикум, стр. 92)
Fe(NCS)3(р) + 3С2О42–(р) D
красный бесцветный
Таблица. Результаты наблюдений и выводы
| Наблюдения | Изменение концентрации | Выводы | ||||||
| Добавляемое вещество | Изменение окраски раствора | FeCl3 | NH4NCS | Fe(NCS)3 | NH4Cl | Смещение положения равновесия в системе | ||
| Эталон | красная | Первоначальные равновесные концентрации | Установившееся равновесие | |||||
| FeCl3 | ||||||||
| NH4NCS | ||||||||
| NH4Cl | ||||||||
| H2C2O4 | ||||||||
Выводы:
1. (Сформулировать условия химического равновесия, используя кинетическое и термодинамическое выражения закона действующих масс. Написать выражение константы равновесия 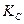 )
)
2. (Сделать выводы об изменении равновесных концентраций компонентов и величины константы равновесия 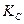 , а также о смещении положения равновесия в системе при добавлении: а) FeCl3; б) NH4NCS; в) NH4Cl; г) Н2С2О4)
, а также о смещении положения равновесия в системе при добавлении: а) FeCl3; б) NH4NCS; в) NH4Cl; г) Н2С2О4)
Опыт 2. Влияние кислотности среды на положение химического равновесия
Реагенты: K2CrO4, H2SO4
Уравнение реакции: 2K2CrO4 + H2SO4 D K2Cr2O7 + K2SO4 + Н2О
желтый оранжевый
уравнение реакции в ионном виде: 2CrO42– +
Реагенты: K2Cr2O7, KOH
Уравнение реакции: K2Cr2O7 + 2KOH D 2K2CrO4 + Н2О
оранжевый желтый
уравнение реакции в ионном виде: Cr2O72– +
Таблица. Результаты наблюдений и выводы
| Наблюдения | Выводы | ||||
| Исходный раствор | Добав-ляемый раствор | Измене-ние окраски | Уравнение реакции | Смещение положения равновесия | |
| состав | окраска | в ионном виде | CrO42–DCr2O72– | ||
| K2CrO4 | H2SO4 | ||||
| K2Cr2O7 | NaOH | ||||
| K2Cr2O7 | BaCI2 |
Выводы:
1. (Объяснить изменение окраски растворов K2CrO4 и K2Cr2O7 при добавлении соответственно H2SO4, NaOH BaCI2 с точки зрения смещения положения установившегося в них равновесия)
Опыт 3. Влияние изменения температуры на смещение положения равновесия реакции образования йодокрахмала
Реагенты: I2 (водный раствор), (С6Н10О5)n (крахмал)
Уравнение реакции (лабораторный практикум, стр. 95):
(С6Н10О5)n + mI2 D
темно-синий
Таблица. Результаты наблюдения и выводы
| Изменение температуры | Изменение окраски раствора | Смещение положения равновесия реакции (С6Н10О5)n + mI2 D (С6Н10О5)n × mI2 | Знак теплового эффекта реакции (∆rН) |
| Нагревание | обратной: | ||
| Охлаждение | прямой: |
Выводы:
1. (Объяснить причину исчезновения темно-синей окраски при нагревании раствора и ее появление вновь при его охлаждении. Указать, какая из особенностей истинного химического равновесия при этом проявляется)
2. (Сделать выводы о направлении смещения положения равновесия реакции образования йодокрахмала при нагревании и охлаждении раствора. Отметить, какая из реакций (прямая или обратная) является эндотермической (DrH > 0))
Шифр для выполнения ДЗ по теме « ХИМИЧЕСКОЕ РАВНОВЕСИЕ»
(условия задач на стр.96-97 лабораторного практикума)
| Вариант | Задачи | ||
