Тема: Кинетика химических реакций
План:
1. Скорость химических реакций.
2. Зависимость химических реакций от концентрации веществ.
3. Зависимость химических реакций от температуры и природы реагирующих веществ.
4. Катализ.
5. Скорость реакции гетерогенных системах.
6. Цепные реакции.
1.
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни; известны реакции, требующие для своего протекания несколько лет, десятилетий и еще более длительных отрезков времени. Кроме того, одна и та же реакция может в одних условиях, например, при повышенных температурах, протекать быстро, а в других, — например, при охлаждении, — медленно; при этом различие в скорости одной и той же реакции может быть очень большим.
Знание скоростей химических реакций имеет очень большое научное и практическое значение. Например, в химической промышленности при производстве того или иного вещества от скорости реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта.
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда — вещества, окружающие систему. Обычно система физически отграничена от среды.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы, гетерогенной— система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом. Другим примером гомогенной системы может служить раствор нескольких веществ в одном растворителе, например раствор хлорида натрия, сульфата магния, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фазы! из газовой фазы в первом примере и из водного раствора во втором.
В качестве примеров гетерогенных систем можно привести следующие системы: вода со льдом, насыщенный раствор с осадком, уголь и сера в атмосфере воздуха. В последнем случае система состоит из трех фаз: двух твердых и одной газовой.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора
H2S04 + Na2S203 = Na2S04 + Н20 + S02f + S|
Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте Fe + 2HCl=FeC12 + H2 может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества. В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема фазы:
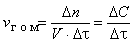 ,
,
где n – количество вещества, моль; V – объем фазы, л; t – время; С – концентрация, моль/л.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
 ,
,
где S – площадь поверхности раздела фаз.
К важнейшим факторам, влияющим на скорость гомогенной реакции, являются следующие: природа реагирующих веществ, их концентрации, температура, присутствие катализаторов.
Таким образом, скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
2.
Зависимость скорости реакции от концентраций реагирующих веществ.
Реакция между молекулами происходит при их столкновении. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ. Число соударений тем больше, чем выше концентрация каждого из исходных веществ. Например, скорость реакции A + B ® C пропорциональна произведению концентраций А и В:
v = k×[A]×[B] ,
где k – коэффициент пропорциональности, называемый константой скорости реакции. По смыслу величина k равна скорости реакции для случая, когда концентрации реагирующих веществ равны 1 моль/л.
Это соотношение выражает закон действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Гораздо реже реакция осуществляется в результате одновременного столкновения трех реагирующих частиц. Например, реакция
2А+В ® А2В
может протекать путем тройного столкновения:
А+А+В ® А2В
Тогда в соответствии с законом действия масс концентрация каждого из реагирующих веществ входит в выражение скорости реакции в степени, равной коэффициенту в уравнении реакции:
v = k×[A]×[A]×[B] = k×[A]2[B]
Сумма показателей степенив уравнении закона действия масс называется порядком реакции. Например, в последнем случае реакция имеет третий порядок (второй - по веществу A и первый - по веществу B.
3.
Зависимость скорости реакции от температуры.
Если воспользоваться результатами подсчета числа столкновений между молекулами, то количество столкновений окажется настолько большим, что все реакции должны будут протекать мгновенно. Это противоречие можно объяснить тем, что в реакцию вступают лишь молекулы, обладающие некоторой энергией.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации
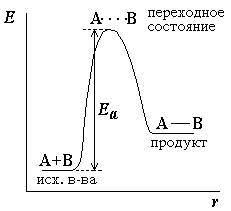 Рисунок – энергетическая диаграмма для реакции образования продукта АВ из исходных веществ А и В. Если энергия столкновения молекул А и В больше или равна энергии активации Еа, то энергетический барьер преодолевается, и происходит перемещение вдоль координаты реакции r от исходных веществ к продукту. Иначе имеет место упругое столкновение молекул А и В. Вершина энергетического барьера соответствует переходному состоянию (активированному комплексу), в котором связь А–В образовалась частично. Рисунок – энергетическая диаграмма для реакции образования продукта АВ из исходных веществ А и В. Если энергия столкновения молекул А и В больше или равна энергии активации Еа, то энергетический барьер преодолевается, и происходит перемещение вдоль координаты реакции r от исходных веществ к продукту. Иначе имеет место упругое столкновение молекул А и В. Вершина энергетического барьера соответствует переходному состоянию (активированному комплексу), в котором связь А–В образовалась частично. |
С ростом температуры число активных молекул возрастает. Следовательно, скорость химической реакции должна увеличиваться с ростом температуры. Возрастание скорости реакции при нагревании принято характеризовать температурным коэффициентом скорости реакции (g) – числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры на 10 градусов. Математически эта зависимость выражается правилом Вант-Гоффа:
 ,
,
где v1 – скорость при температуре t1; v2 – скорость при температуре t2. Для большинства реакций температурный коэффициент g лежит в пределах от 2 до 4.
Более строго зависимость скорости реакции (а точнее, константы скорости) от температуры выражается уравнением Аррениуса:
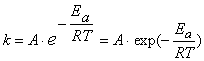 ,
,
где A – предэкспоненциальный множитель, зависящий только от природы реагирующих веществ; Ea – энергия активации, представляющая собой высоту энергетического барьера, разделяющего исходные вещества и продукты реакции (см. рисунок 2.1); R – универсальная газовая постоянная; T – абсолютная температура.
Снижение энергии активации по каким-либо причинам, согласно уравнению Аррениуса, приводит к увеличению скорости реакции.
4.
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими.
 В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны., Иначе говоря, в присутствии, катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора. Таким образом, энергия активации реакции понижается; некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны., Иначе говоря, в присутствии, катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора. Таким образом, энергия активации реакции понижается; некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
А + В ® АВ – некаталитическая реакция
А + С + В ® АС + В ® АВ + С – каталитическая реакция (С – катализатор)
В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии протекают с меньшими энергиями активации. Иначе говоря, в присутствии катализатора возникают другие переходные состояния, чем без него, и для их образования требуется меньше энергии, чем для образования переходных состояний, возникающих без катализатора. В результате скорость реакции возрастает.
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы.
5.
Рассматривая гетерогенные реакции, нетрудно заметить, что они тесно связаны с процессами переноса вещества. В самом деле, для того, чтобы реакция, например, горения угля могла протекать, необходимо, чтобы диоксид углерода, образующийся при этой реакции, все время удалялся бы от поверхности угля, а новые количества кислорода подходили бы к ней. Оба процесса (отвод С02 от поверхности угля и подвод 02 к ней) осуществляются путем конвекции (перемещения массы газа или жидкости) и диффузии.
Таким образом, в ходе гетерогенной реакции можно выделить по меньшей мере три стадии:
1. Подвод реагирующего вещества к поверхности;
2. Химическая реакция на поверхности;
3. Отвод продукта реакции от поверхности.
При установившемся режиме реакции все три стадии ее протекают с равными скоростями. Однако не во всех случаях скорость гетерогенной реакции определяется скоростью переноса вещества. Определяющей стадией реакций, энергия активации которых велика, является вторая стадия — собственно химическая реакция. Естественно, что скорость протекания таких реакций не будет возрастать при усилении перемешивания. Например, реакция окисления железа кислородом влажного воздуха не ускоряется при увеличении подачи воздуха к поверхности металла, поскольку здесь энергия активации химической стадии процесса значительна.
Стадия, определяющая скорость протекания реакции, называется лимитирующей стадией. В первом примере лимитирующей стадией является перенос вещества, во втором — собственно химическая реакция.
6.
Цепные реакции,химические и ядерные реакции, в которых появление промежуточной активной частицы (свободного радикала, атома или возбуждённой молекулы — в химических, нейтрона — в ядерных процессах) вызывает большое число (цепь) превращений исходных молекул или ядер вследствие регенерации активной частицы в каждом элементарном акте реакции (в каждом звене цепи).
Неразветвлённые Ц. р.
Химические процессы с неразветвлёнными цепями можно рассмотреть на примере фотохимической реакции между водородом и хлором. В этой Ц. р. молекула хлора, поглощая квант света, распадается на два атома. Каждый из образовавшихся атомов хлора начинает цепь химических превращений; в этой цепи атомы хлора и водорода выступают в качестве активных частиц. Длина цепи может быть очень большой — число повторяющихся элементарных реакций продолжения цепи на один зародившийся активный центр может достигать десятков и сотен тысяч. Обрыв цепей происходит в результате рекомбинации атомов в объёме реактора, захвата атомов его стенкой с последующей рекомбинацией на стенке, образования неактивного радикала при реакции активных центров с молекулами всегда присутствующих примесей [например, при реакции между атомарным водородом и молекулами кислорода (примесями) с образованием радикала HO2; этот радикал в условиях не очень высоких температур не реагирует с исходными молекулами].
Реакцию между H2 и Cl2, вызванную действием кванта света hn, можно представить схемой:
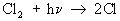 — зарождение цепи
— зарождение цепи
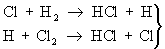 — продолжение цепи
— продолжение цепи
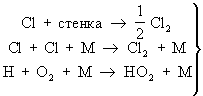 — обрыв цепи
— обрыв цепи
Реакции с разветвленными цепями. В ходе разветвленных Ц. р. при взаимодействии одного из активных центров возникает более чем один (часто — три) новый активный центр, т. е. происходит размножение цепей.
Примером разветвленной Ц. р. может служить окисление водорода, где разветвление и продолжение цепей происходит по схеме:
(1) Н + O2 ® OH + О — разветвление
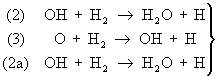 — продолжение
— продолжение
или в сумме Н + 3H2 + O2 = 2H2O + 3H.
Наряду с образующимися в реакциях 1—3 активными центрами Н и OH, обеспечивающими развитие неразветвлённой цепи, в реакции (1) образуется атом кислорода, формально обладающий двумя свободными валентностями и способный легко входить в реакцию (3) с образованием Н и OH — ещё двух носителей цепей. Такой тип разветвления был назван материальным.
В реакциях с т. н. энергетическим разветвлением размножение цепей осуществляется за счёт возбуждённых частиц — продуктов экзотермических реакций развития цепи. Например, при взаимодействии фтора с водородом развитие цепей происходит по схеме:
(1) F2 ® 2F
(2) F + H2 ® HF* + Н
(3) Н + F2 ® HF* +F
(4) HF* + H2 ® HF + H2*
(5) H2* + F2 ® HF + H + F
В реакциях (2) и (3) наряду с атомами Н и F образуются колебательно-возбуждённые молекулы HF*, которые передают избыток энергии молекуле H2 [реакция (4)]. В результате столкновения обогащенной энергией молекулы H2* с молекулой F2 образуется молекула HF и атомы Н и F [реакция (5)], начинающие новые цепи (энергетическое разветвление).
