В чем сущность электролиза? Электролиз с нерастворимыми и растворимыми электродами. Рассмотрите на конкретных примерах ( водные растворы)
Электролизом называется совокупность процессов, протекающих на электродах при прохождении через электролит постоянного эл.тока. 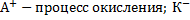 процесс восстановления
процесс восстановления
Материалом электродов должен быть электропроводящий материал. Независимо от материала катода процесс восстановления заключается присоединением электродов катода ионом металла , находящемся в растворе. Ионы восстанавливаются до атомов или молекул. В отличии от катодного процесса материал анода оказывает влияние на электродные процессы. Если материал электрода не взаимодействует с электролитом, то процесс окисления заключается в отдаче электронов анодом. При этом анод окисляется либо до атомов, либо до молекул (в виде веществ). В этом случае анод называется нерастворимым. В случае, если материал анода взаимодействует с электродом, то процесс окисления заключается в переходе атомов металла в раствори в виде катионов.
Электролиз водных растворов. При нем в электродных процессах, кроме ионов электрода принимают участие молекулы воды. Характер протекания электродных процессов в водных растворах определяется по положению металла в ряду напряжений. При электролизе на катоде возможны 3 варианта в электродных процессах:
1) Если металл расположен правее 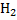 то на К происходит восстановление ионов данного Ме.
то на К происходит восстановление ионов данного Ме.
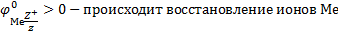
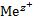 + z*e=Me
+ z*e=Me
2) Если Ме расположен между водородом и алюминием (до алюминия), то на электроде возможно 2 процесса протекания.
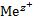 + z*e=Me
+ z*e=Me
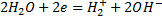
Если Ме имеет меньший потенциал, чем у алюминия, то протекает только процесс восстановления молекул воды.
Билет 27
Количественные характеристики процесса электролиза.
Напряжение разложения:
Из закона Ома U= 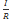 следует что при постоянной силе тока, требуется тем большее напряжение, чем выше напряжений разложения раствора.
следует что при постоянной силе тока, требуется тем большее напряжение, чем выше напряжений разложения раствора.
.Законы Фарадея, лежащие в основе электролиза.
Первый Закон Фарадея:
Масса вещества, выделившегося на электроде при прохождении по раствору
электролита электрического тока, прямо пропорциональна количеству электричества”.
∆m=k
э
Q
где ∆m – количество прореагировавшего вещества; Q – количество электричества; kэ
коэффициент пропорциональности, показывающий, сколько вещества прореагировало
при прохождении единицы количества электричества.
Величина, k называется электрохимическим эквивалентом
k=M/(N
A
z│e│)
где z – валентность иона; M – молярная масса вещества, выделившегося на
электроде; NA—постоянная Авогадро, │e│= 1,6• 10
-19
Кл.
Второй Закон Фарадея.
Согласно второму закону Фарадея, при определённом количестве прошедшего
электричества отношения масс прореагировавших веществ равно отношению их
химических эквивалентов:
∆m
1
/A
1 =∆m
2
/A
2
=∆m
3
/A
3
=const
Выход по току – отношение количества теоритически необходимого для получения
того или иного количества электричества (по закону Фарадея) к практически
затраченному количеству электричества. С целью уменьшения затрат электроэнергии
на побочные электрохимические реакции и повышения по току стремятся проводить
электролиз в таких условиях, при которых затруднено разложение растворителя,
т.е. велика поляризация при окислении или восстановлении растворителя (например
перенапряжение кислорода или водорода). Это достигается повышением плотности
тока, изменением температуры электролита, подбором материала электролита и т. д.
Выход по току (ВПТ) может быть определен как отношение количества вещества, фактически полученного при электролизе g, к тому его количеству g0, которое должно быть получено по расчету, в соответствии с прошедшим количеством электричества: ВПТ= (g/ g0)∙100%.
Билет № 28
Механизм электрохимической коррозии.
Факторы, влияющие на электрохимическую коррозию.
Электрохимическая коррозия – разрушение металлов под воздействием окружающей среды возникновением в системе эл тока. Это самый распространенный вид коррозии. Она отличается от химической тем, что имеется пространственное разделение процессов окисления и восстановления. В металле присутствуют участки с окислителем и с восстановителем. На аноде идет окисление металла, а на катоде – восстановление окислителя. Окислителями могут быть:
· ионы водорода (коррозия водородной деионизации);
· ионы кислорода (коррозия кислородной деионизации);
В большинстве случаев протекание электрохимической коррозии характеризуется локализацией анодного и катодного процессов на различных участках корродирующей поверхности металла. Это приводит к неравномерному или местному коррозионному разрушению металлической поверхности. На процессы электрохимической коррозии металлов существенно влияют как внутренние, так и внешние факторы.
К внутренним факторам следует отнести
· термодинамическую устойчивость металла,
· состояние его поверхности,
· структурную неоднородность,
· влияние напряжений и др.
К внешним факторам относятся факторы, связанные с составом коррозионной среды и условиями коррозии (температура, скорость движения среды, давление и др.).
Этот вид коррозии наиболее распространен и включает те случаи, когда процессы окисления металла и восстановления окислительного компонента протекают раздельно в среде жидкого электролита, т.е. в среде, проводящей электрический ток. Такими средами могут являться: природная вода, водные растворы солей, кислот, щелочей, а также воздух, почва и теплоизоляционные конструкции, содержащие электролит (влагу) в определенном количестве. Таким образом, процесс электрохимической коррозии представляет собой совокупность двух сопряженно протекающих реакций:
анодной (окисление) Ме → Ме z+ + ze- (2),
и катодной (восстановление) D + ze- → (Dze- ) (3),
где D – деполяризатор (окислитель), присоединяющий к себе электроны металла. В качестве деполяризатора могут выступать: кислород, растворенный в электролите, ионы водорода (Н+) и некоторых металлов. Частный случай ржавления железа описывается реакцией:
2Fe + 2H2O + O2 → 2Fe2+ + 4 OH- (4).
| 29 билет Электрохимические методы защиты металлов от коррозии. Их принцип. Электрохимическая защита. Этот метод защиты основан на тормо-жении анодных или катодных реакций коррозионного процесса. Электрохимическая защита осуществляется присоединением к защи-щаемой конструкции металла с более отрицательным значением элект-родного потенциала - протектора, а также катодной или анодной поляризацией за счет извне приложенного тока. Наиболее применима электрохимическая защита в коррозионных средах с хорошей элект-рической проводимостью. Катодная поляризация используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную ващиту применяют также к шлюзовым воротам, подводным лодкам, водный резервуарам, морским трубопроводам и оборудованию хи-мических заводов. Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источ-ника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. При электро-лизе вспомогательный электрод (анод) растворяется, на защищаемом сооружении (катоде) выделяется водород. Если вспомогательный анод изготовлен из металла, имеющего более отрицательный потенциал, чем защищаемый металл, то возникает гальванический элемент. При этом отпадает необходимость в наложении тока от внешнего исгоц-ника. Анод растворяется со скоростью, достаточной для создания в системе электрического тока необходимой силы. Подобные вспомога-тельные электроды называют протекторалiи. Для их изготовления большей частью используют магний и его сплавы, цинк, алюминий. Разработала также защита металла от коррозии наложением анод- ной поляризации. Этот метод применим лишь к металлам и сплавах, способным легко пассивироваться при смещении их потенциала в положительную сторону. Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте. | 18:00:06 |
Билет 30
Защита металлов от коррозии путем изоляции от окружающей среды.
Защитные покрытия. Слои, искусственно создаваемые на по_ верхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно-декоративным. Выбор вида покрытия зависит от условий, в которых используется металл. Материалами для металлических защитных покрытий могут быть как чистые ме-таллы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), таки их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на катод-ные и анодные. К катодным покрытиям относятся покрытия, потен-циалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Си, Ni, А. При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в ко-тором основной материал в поре служит анодом и растворяется, а материал покрытия - катодом, на котором выделяется водород или поглощается кислород (рис. 74). Следовательно, катодные-покрытия могут защищать металл от коррозии лишь при отсутствии пор ii пов-реждений покрытия. Анодные покрытия имеют более отрицательный.
Потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали. В этом примере основной металл будет катодом коррознонного элемента, поэтому он не корро-дирует (рис. 75). Потенциалы металлов меняются в зависимости от состава растворов, поэтому при изменении состава раствора может меняться н характер покрытия. Так, покрытие стали оловом в раст-воре Н_8О4 - катодное, а в растворе органических кислот - анодное.
Для получения мета ллических защитных покрытии применяются раз личные споссбы: электрохимический (гальванические покрытия), погружение в расплавленный мета чл, металлизация, термодиффузи-онный и химический (см. § 52). Из расплава получают покрытие иннка (горячее цинкование) и олова (горячее лужение).
