Принципы расчета энтальпии и энтропии смешения
Принципы расчета энтальпии и энтропии смешения были развиты в работах Гильдебранда, Ван-Лаара, Лоренца и др. в 20-30 гг. XX в. применительно к растворам низкомолекулярных соединений и в 40-х гг. - Флори для растворов высокомолекулярных соединений.
Энтальпия смешения. При растворении происходит разрыв слабых межмолекулярных физических связей между одинаковыми молекулами, что приводит к поглощению тепла и образованию новых связей между разными молекулами, что сопровождается выделением тепла. Следовательно, суммарный тепловой эффект будет зависеть от энергии межмолекулярных контактов каждого типа и от числа контактов, приходящихся на одну молекулу. Рассмотрим процесс смешения двух веществ, молекулы которых имеют равные объемы. Обозначим через еij энергию одного контакта, т.е. энергию, необходимую для разделения двух молекул, и через Еij - энергию, необходимую для разделения одного моля пар молекул. Пусть один моль компонента 2 переносится в большой избыток компонента 1. Тогда необходимая для этого энергия ΔЕ будет связана с энергиями межмолекулярных контактов следующим образом:
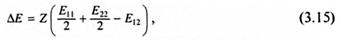
где Е11 Е22, Е12 - мольные энергии взаимодействия одинаковых и разных молекул, Z - число контактов одной молекулы с окружающими ее молекулами. Величина ΔЕ или аналогичная ей Δе = ΔE/NA, где NA - число Авогадро, называется энергией взаимообмена. Исходя из (3.15), можно выделить три случая.
При Е12 = (Е11 + Е22)/2 растворение является атермическим, такая ситуация характерна для смешения неполярных веществ.
При Е12 > (E11 + Е22)/2 растворение является экзотермическим, т.е. происходит с выделением энергии в форме теплоты. Такая ситуация характерна для сильного межмолекулярного взаимодействия разных молекул, вызванного, например, образованием водородных связей.
Наибольший интерес представляет третий случай. В 1925 г. Ван-Лааром и Лоренцем было высказано предположение, что для веществ умеренной полярности

Считается, что соотношение (3.16) хорошо описывает межмолекулярное взаимодействие посредством наиболее универсальных дисперсионных сил, следовательно, оно применимо к широкому кругу систем.
Из (3.16) следует, что тепловой эффект смешения малополярных веществ является эндотермическим, поскольку среднее геометрическое всегда меньше среднего арифметического.
Энергии межмолекулярных контактов непосредственно измерить невозможно, однако, они могут быть выражены через макровеличины. При парообразовании или сублимации тепловой эффект обусловлен затратой (расходом) энергии на разрыв межмолекулярных связей, следовательно:
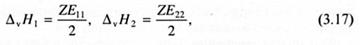
где ΔvH1, ΔvH2 - мольные энтальпии парообразования или сублимации компонентов 1 и 2. Объединяя уравнения (3.16) - (3.18), получаем:

В более сложном случае, когда мольные объемы смешивающихся веществ 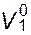 и
и 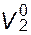 различаются, следует использовать другое уравнение. Оно может быть легко получено, исходя из аналогичных рассуждений на основе решеточной модели. При этом допускается, что число контактов молекулы с окружающими ее другими молекулами пропорционально мольному объему первой. Подобным путем было получено:
различаются, следует использовать другое уравнение. Оно может быть легко получено, исходя из аналогичных рассуждений на основе решеточной модели. При этом допускается, что число контактов молекулы с окружающими ее другими молекулами пропорционально мольному объему первой. Подобным путем было получено:

или

где V- объем смеси (раствора); φ1, φ2 - объемные доли компонентов. Величина ΔvH1/V, равная энергии парообразования единицы объема жидкости или сублимации единицы объема твердого вещества, называется плотностью энергии когезии.
Величина
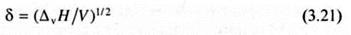
называется параметром растворимости Гильдебранда. В настоящее время это единственный количественный параметр, на основе которого можно сделать вывод о вероятности смешения (растворения) веществ. Считается, что вероятность образования истинного, т.е. термодинамически устойчивого раствора тем больше, чем меньше разница в величинах параметров растворимости компонентов, и максимальна при δ1 = δ2.
Рассмотренные представления были перенесены на растворы высокомолекулярных соединений, однако в этом случае, ввиду нелетучести макромолекул, параметры растворимости полимера приходится определять косвенным путем. Один из них состоит в том, что слабо сшитые образцы полимера помещают в разные растворители и за значение его параметра растворимости принимают значение параметра растворимости того растворителя, в котором полимер набухает в наибольшей степени. Согласно другому методу, измеряют характеристическую вязкость полимера в различных растворителях и за величину его параметра растворимости принимают величину параметра растворимости того растворителя, где характеристическая вязкость раствора полимера максимальна. В табл. 3.1 приведены значения параметров растворимости ряда растворителей, полимеров и мономеров.
Таблица 3.1 Значения параметров растворимости некоторых растворителей, полимеров и мономеров
| Растворители | δ·10-3, (Дж/м3)0,5 | Полимеры | δ·10-3, (Дж/м3)0,5 | Мономеры | δ·10-3, (Дж/м3)0,5 |
| н-Гексан | 14,6 | Политетра- фторэтилен | 12,5 | Изопрен | 14,8 |
| Диэтиловый эфир | 14,8 | Полидиметил- силоксан | 14,6 | Бутилмет- акрилат | 17,0 |
| н-Октан | 15,1 | Полиизо- бутилен | 15,8 | Винил- хлорид | 17,8 |
| Этилацетат | 18,2 | Полиэтилен | 15,9 | Метил- акрилат | 18,2 |
| Бензол | 18,3 | Полиизопрен | 16,3 | Стирол | 18,3 |
| Хлороформ | 18,6 | Полибутил- метакрилат | 17,6 | Метилмет- акрилат | 18,4 |
| Дихлорэтан | 19,6 | Полистирол | 18,2 | Винилацетат | 18,4 |
| Тетрагидро- фуран | 19,8 | Полиметил- метаакрилат | 18,6 | Акрило- нитрил | 21,4 |
| Нитробензол | 20,0 | Поливинил- ацетат | 18,8 | N-Винил- пирролидон | 21,422,2 |
| Ацетон | 20,2 | Поливинил- хлорид | 19,1 | ||
| Диметилформ- амид | 24,2 | Полиэтилен- терефталат | 20,2 | ||
| Этанол | 25,4 | Эпоксидная смола | 21,8 | ||
| Метанол | 29,0 | Полиокси- метилен | 22,0 | ||
| Вода | 46,4 | Полиакрило- нитрил | 30,8 |
Параметры растворимости оказались полезными при подборе растворителей полимеров, особенно в лакокрасочной промышленности, пластификаторов, приготовлении смесей полимеров. Существуют способы расчета параметров растворимости низкомолекулярных соединений и полимеров, исходя из вкладов функциональных групп. В случае смесей растворителей параметр растворимости рассчитывается по аддитивной схеме. Однако, как следует из рис. 3.1, параметры растворимости некоторых смесей далеки от аддитивности.
Со временем представления о природе параметра растворимости расширились. Согласно Хансону, величина параметра растворимости определяется всеми составляющими сил межмолекулярного взаимодействия:


где δd, δh, δi - вклады, определяемые дисперсионными силами, водородными связями и индукционным эффектом.
В общем случае энергия взаимообмена ΔЕ определяет изменение внутренней энергии системы при смешении компонентов. И лишь в том случае, когда объем не меняется, тепловой эффект растворения практически равен энергии взаимообмена, т. е.

Энтропия смешения. Рассмотрим изменение энтропии при смешении двух компонентов с одинаковым размером молекул и одинаковой энергией взаимодействия всех молекул (ΔЕ = 0). В этом случае можно ожидать, что останутся неизменными составляющие энтропии, обусловленные вращательным, поступательным и колебательным движениями молекул, и, кроме того, в смеси появится новая составляющая энтропии, связанная с возможностью перестановок молекул относительно друг друга. Это специфическое приращение энтропии при образовании смеси носит название конфигурационной энтропии Sk. Исходя из сказанного выше, можно полагать, что для идеальных смесей именно этот вклад практически полностью обусловливает энтропию смешения, т. е.

Для расчета Sk представим, что каждая из молекул смеси расположена в ячейке плоской решетки. Если мы имеем N1 молекул компонента 1 и N2 молекул компонента 2, то число возможных перестановок в N1 + N2 ячейках решетки равно:

Рассматривая число перестановок как число микросостояний и, следовательно, как термодинамическую вероятность системы, мы можем применить формулу Больцмана:

где k - постоянная Больцмана. Преобразовав (3.25) при помощи формулы Стирлинга (y! = y/ey) и используя полученный результат в правой части (3.26), окончательно получаем:

где N1, N2 - число молекул; n1, n2 - число молей; Х1 Х2 - мольные доли компонентов 1 и 2; R - универсальная газовая постоянная, связанная с постоянной Больцмана k через число Авогадро k = R/NA.
Теория Флори-Хаггинса
Первая термодинамическая теория растворов полимеров была разработана независимо Флори и Хаггинсом в 40-50 гг. XX в. Эта теория сыграла большую роль в понимании физической природы растворов полимеров, многие ее положения используются до настоящего времени.
В теории Флори-Хаггинса предполагается, что раствор является регулярным (Регулярный раствор, в отличие от идеального, не является атермическим, но имеет такое же случайное распределение молекул растворенного вещества и растворителя.), а звенья цепей распределены равномерно по всему объему. Это условие не может быть выполнено для очень разбавленных растворов, так как в таком растворе клубки разделены чистым растворителем. Поэтому, строго говоря, теория Флори-Хаггинса применима лишь к умеренно концентрированным или полуразбавленным растворам, для которых характерно заметное перекрывание клубков.
Расчет энтропии и энтальпии смешения в теории Флори-Хаггинса проводится на основе модели квазикристаллической решетки, каждая ячейка которой может быть занята либо молекулой растворителя, либо сегментом макромолекулы. В данном случае под сегментом понимается отрезок цепи, объем которого равен объему молекулы растворителя. На рис. 3.2 приведено двухмерное изображение заполненной решетки. Предполагается, что ΔVсм = 0. Общее количество ячеек в решетке равно N1 + σN2, где N1 = n1·NA, N2 = n2·NA; n1, n2 - число молей молекул растворителя и растворенного вещества; σ =  - число сегментов цепи.
- число сегментов цепи.
Каждая ячейка окружена определенным числом ближайших ячеек. Это число, называемое координационным, обозначается как Z. Оно зависит от типа решетки, однако, на конечные результаты теории влияния не оказывает.

Обозначим через ƒi долю ячеек, заполненных сегментами:

где 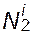 - i молекул N2. Рассмотрим число возможных способов размещения (
- i молекул N2. Рассмотрим число возможных способов размещения ( 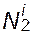 +1)-й макромолекулы, последовательно заполняя ячейки сегментами. Первый сегмент может быть помещен в любую свободную ячейку, т.е. (1 - ƒi)(N1 + σN2) способами. Второй сегмент необходимо поместить в одну из Z ячеек, окружающих первый сегмент. Третий сегмент необходимо поместить в Z - 1 ячейку из окружающих второй сегмент. В теории Флори-Хаггинса принимается, что число способов размещения сегментов не отличается, начиная с третьего, оно обозначается как (1 - ƒj)y, где у зависит от гибкости цепи. Из рассмотренного
+1)-й макромолекулы, последовательно заполняя ячейки сегментами. Первый сегмент может быть помещен в любую свободную ячейку, т.е. (1 - ƒi)(N1 + σN2) способами. Второй сегмент необходимо поместить в одну из Z ячеек, окружающих первый сегмент. Третий сегмент необходимо поместить в Z - 1 ячейку из окружающих второй сегмент. В теории Флори-Хаггинса принимается, что число способов размещения сегментов не отличается, начиная с третьего, оно обозначается как (1 - ƒj)y, где у зависит от гибкости цепи. Из рассмотренного
следует, что число способов размещения ( 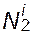 +1)-ой макромолекулы в решетке пропорционально произведению чисел способов размещения последовательно связанных сегментов:
+1)-ой макромолекулы в решетке пропорционально произведению чисел способов размещения последовательно связанных сегментов:

Множитель 1/2 вводится по той причине, что концы макромолекулы неразличимы, а при изложенном подходе каждая макромолекула помещается в решетку два раза, начиная с одного и другого конца.
После завершения расположения макромолекул на оставшиеся места (свободные ячейки) помещаются молекулы растворителя. Однако они не отличаются друг от друга, поэтому имеется лишь один способ их размещения. В итоге общее число возможных вариантов размещения сегментов в растворе, т.е. число микросостояний выразится произведением:

где член 1/N2! введен для того, чтобы учесть перестановки макромолекул между собой, которые не влияют на W. После логарифмирования уравнения (3.31) и ряда преобразований (Тенфорд Ч. Физическая химия полимеров. М: Химия, 1965.), включающих использование формулы Стирлинга и уравнения (3.26), получаем:

Поскольку в рассматриваемой модели предполагается равенство объемов, занимаемых молекулой растворителя и сегмента макромолекулы, то:
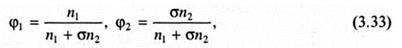
где φ1, φ2 - объемные доли растворителя и растворенного полимера. С учетом этого уравнение (3.32) приобретает следующий вид:
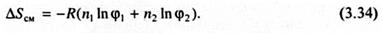
На основе решеточной модели раствора была также рассчитана энтальпия смешения ΔHсм. Обозначим e11, e22, е12 энергию одного контакта, т.е. энергию, необходимую для разделения двух молекул растворителя, двух сегментов макромолекул и молекулы растворителя с сегментом полимера. Каждая молекула растворителя имеет в своем непосредственном окружении (координационной сфере) из Z ячеек

То же самое можно сказать о сегментах макромолекул, но, поскольку их контакты с растворителем учтены выше, отметим лишь то, что каждый сегмент контактирует с

С учетом обозначенных выше контактов энтальпия смешения n1 моль и n2 моль растворенного вещества (полимера) будет описываться следующим выражением:
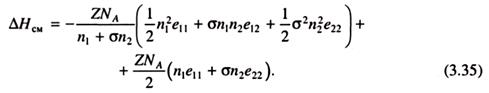
Это выражение можно переписать в более простой форме:

где ΔЕ - энергия взаимообмена, в данном случае равная:

Поскольку число Z не может быть определено в рамках теории Флори-Хаггинса, вводится полуэмпирический параметр 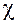 , называемый параметром взаимодействия Флори-Хаггинса. Согласно определению:
, называемый параметром взаимодействия Флори-Хаггинса. Согласно определению:

где Δе и ΔЕ - молекулярная и молярная энергии взаимообмена. Из (3.38) следует, что  1 численно равен энергии, необходимой для переноса одной молекулы или одного моля растворителя из чистого растворителя в полимер, отнесенной к «тепловой» энергии kТипи RT. С учетом (3.38)
1 численно равен энергии, необходимой для переноса одной молекулы или одного моля растворителя из чистого растворителя в полимер, отнесенной к «тепловой» энергии kТипи RT. С учетом (3.38)

Используя выражение для ΔSсм (3.34) и для ΔSсм (3.39), легко может быть получено выражение для функции Гиббса смешения:

Выражение, описывающее изменение химического потенциала растворителя в растворе полимера, Флори и Хаггинс получили через парциальную энтальпию и энтропию смешения 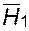 и
и 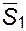 поскольку
поскольку

Конечный результат имеет вид:
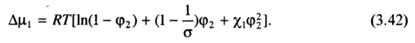
Выражения для активности компонентов получены Хаггинсом. Ниже приводится одно из них, описывающее активность растворителя в растворе полимера:

Уравнения (3.40), (3.42), (3.43) наиболее значимы в рассматриваемой теории. Знак ΔGсм определяет принципиальную возможность растворения, а значения Δµ1 и In a1 определяют экспериментально изучаемые свойства растворов полимеров - осмотическое давление и упругость пара растворителя над раствором.
Теория Флори - Хаггинса, несмотря на недостатки, некоторые из которых будут отражены ниже, по праву считается классической, а параметр взаимодействия 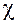 1 до настоящего времени остается основным параметром, характеризующим термодинамические свойства растворов и смесей полимеров. Значения этого параметра для некоторых систем приведены в табл. 3.2, откуда следует, что имеет место некоторая зависимость
1 до настоящего времени остается основным параметром, характеризующим термодинамические свойства растворов и смесей полимеров. Значения этого параметра для некоторых систем приведены в табл. 3.2, откуда следует, что имеет место некоторая зависимость 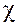 1 от концентрации раствора и молекулярной массы полимера, хотя теория не предусматривает ни того, ни другого. Существует несколько вариантов «улучшенной» теории. Один из них разработан Флори и Киргбаумом для разбавленных растворов полимеров.
1 от концентрации раствора и молекулярной массы полимера, хотя теория не предусматривает ни того, ни другого. Существует несколько вариантов «улучшенной» теории. Один из них разработан Флори и Киргбаумом для разбавленных растворов полимеров.
В модели Флори-Хаггинса предполагалось, что заполнение любой ячейки решетки равновероятно для молекулы или сегмента. Такое допущение справедливо лишь при ΔЕ ≈ 0. Если ΔE ≠ 0, то некоторые из контактов являются более предпочтительными, а это означает, что энтропия смешения не равна в точности конфигурационной энтропии. Эти соображения привели к необходимости корректировки теории, которая была проведена Флори и Киргбаумом путем введения некоторых дополнительных параметров. Было предположено, в частности, что параметр взаимодействия  имеет две составляющие - энергетическую и энтропийную, обозначенные как κ1 и Ψ1. Их физический смысл определяется уравнениями:
имеет две составляющие - энергетическую и энтропийную, обозначенные как κ1 и Ψ1. Их физический смысл определяется уравнениями:

Рассмотрим происхождение второго параметра. В первоначальной теории для парциальной энтропии растворителя получено:

Разложив ln(1 - φ2) в ряд и ограничившись двумя его первыми членами, получаем:
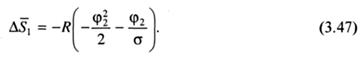
При большом числе а вторым членом уравнения можно пренебречь, следовательно:

Поскольку оказалось, что парциальная энтропия смешения зависит от природы растворителя, авторы ввели множитель Ψ1, чтобы учесть это явление. В результате было получено уравнение (3.45), приведенное выше.
Если в первоначальном варианте теории энергия взаимообмена Δе была выражена через параметр  1 то в усовершенствованном варианте Флори и
1 то в усовершенствованном варианте Флори и
Таблица 3.2 Параметр термодинамического взаимодействия  1 для некоторых растворов полимеров
1 для некоторых растворов полимеров
| Полимер |  1, растворитель 1, растворитель | ||
| Полиэтилен | 0,36 бензол | -0,02 циклогексан | -0,05 н-декан |
| Полиизобутилен | 0,55 н-пентан φ2 = 0,297 | 0,673 … φ2 = 0,496 | 0,630 … φ2 = 0,744 |
| Полистирол | 0,434 дихлорэтан М = 2,4·104 | 0,468 … М = 5,1·105 | 0,478 … М = 1,8·106 |
| Полиметилметакрилат | 0,437 бензол | 0,452 толуол | 0,478 ацетон |
| Поливинилхлорид | 0,770 бензол | 0,457 диоксан | 0,506 хлорбензол |
| Натуральный каучук | 0,418 бензол | 0,444 н-декан | 1,36 ацетон |
Киргбаум связали Δе с параметрами Ψ1, K1 и θ-температурой следующим образом:

Связь между упомянутыми выше параметрами дается соотношением:

