Пример расчета количества выделившихся веществ при электролизе
Сколько кислорода и водорода выделится при электролизе серной кислоты в течение 15 минут, если сила тока равна 2,5 А?
(C-графит) К(-) 2Н+ +SO42-® (+) A(C-графит)
Н+2О-2
| Катодный процесс | Анодный процесс |
2Н++2е®Н2, побочных процессов нет hн2 = 100% или hн2 = 1 mн2 = Kэ н2. I. t, Kэ н2=МН2/2×96500 mн2 = 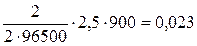 г Согласно закону Авогадро Vн2 = n ·22,4 = = г Согласно закону Авогадро Vн2 = n ·22,4 = = 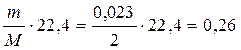 л л | 2Н2О-2-4е ®О02 +4Н+ побочных процессов нет h о2 =100% или hо2=1 mо2= Kэо2. I. t , Kэо2=Мо2/4·96500 mо2 = 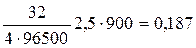 г Согласно закону Авогадро Vо2 = n ·22,4 = = г Согласно закону Авогадро Vо2 = n ·22,4 = = 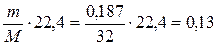 л л |
Рекомендуемая литература:[1], с.281-288, с. 677-681; [2],с.279-299.
КОНТРОЛЬНОЕ ЗАДАНИЕ №12
Тема: «Электролиз»
Задание №1.Рассмотрите электролиз водного раствора соли:
1. Указать электроды.
2. Записать вещества, подвергающиеся электролизу с точки зрения теории электролитической диссоциации.
3. Написать все возможные процессы на катоде и аноде с указанием стандартных и равновесных потенциалов (по уравнению Нернста).
4. Определить какой процесс протекает в первую очередь. Почему?
5. Написать суммарное уравнение электролиза.
Варианты заданий
| № варианта | Состав и концентрация электролита | рН электролита и материал электродов |
| 1. | 0,1 М раствор СdSO4 | рН=4, катод- Cd, анод -С(графит) |
| 2. | 0,1 М раствор MgBr2 | рН=6,2, электроды - Pt |
| 3. | 1 М раствор NiSO4 | рН=5, электроды - Ni |
| 4. | 0,1 М раствор ZnCl2 | рН=5, электроды - Zn |
| 5. | 1 М раствор KNO3 | рН=8, электроды - Pt |
| 6. | 0,1 М раствор MgSO4 | рН=7, катод - Fe, анод - С(графит) |
| 7. | 0,01 М раствор Au(NO3)3 | рН=6, катод - Au, анод - Pt |
| 8. | 1 М раствор CoCl2 | рН=5, катод - Fe, анод - Co |
| 9. | 0,1 М раствор CuSO4 | рН=5, катод - Fe, анод - Cu |
| 10. | 0,01 М раствор SnSO4 | рН=6,2, электроды - Pt |
| 11. | 1 М раствор Cr(NO3)3 | рН=2, катод- Cu, анод - Pt |
| 12. | 0,01 М раствор MnSO4 | рН=6, электроды - Pt |
| 13. | 1 М раствор KNO3 | рН=5, катод- Cu, анод - Ag |
| 14. | 0,01 М раствор HCl | рН=2, электроды - Pt |
| 15. | 0,01 М раствор Al2(SO4)3 | рН=6, электроды - Pt |
| 16. | 0,1 М раствор CuCl2 | рН=4, катод- Fe, анод - Cu |
| 17. | 1 М раствор KOH | рН=14, электроды - Pt |
| 18. | 0,1 М раствор BaCl2 | рН=7, электроды - C(графит) |
| 19. | 1 М раствор AgNO3 | рН=5, катод- Cu, анод - Ag |
| 20. | 0,5 М раствор CdSO4 | рН=4, катод- Fe, анод - Cd |
| 21. | 0,5 М раствор H2SO4l | рН=1, электроды - Pt |
| 22. | 0,01 М раствор NaOH | рН=12, электроды - Pt |
| 23. | 1 М раствор NiCl2 | рН=7, катод- Fe, анод - Pt |
| 24. | 0,1 М раствор NaCl | рН=7, электроды - Pt |
| 25. | 1 М раствор SnSO4 | рН=4, катод- Sn, анод - Sn |
Задание №2.
Сколько граммов металла…. выделится на катоде, если через раствор соли… пропустить ток силой (I)...в течение (t) …. Выход Ме (h) принять за…..
| № варианта | Металл | Соль | I, A | t, мин | hМе, % |
| 1. | Cu | CuSO4 | 0,5 | ||
| 2. | Zn | ZnCl2 | 0,6 | ||
| 3. | Ni | NiSO4 | 0,8 | ||
| 4. | Cr | Cr2(SO4)3 | 1,2 | ||
| 5. | Sn | SnSO4 | 0,5 | ||
| 6. | Ag | AgNO3 | 0,5 | ||
| 7. | Au | Au(NO3)3 | 0,2 | ||
| 8. | Cd | CdSO4 | 0,6 | ||
| 9. | Mn | MnSO4 | 0,4 | ||
| 10. | Pt | PtCl2 | 0,6 |
Через раствор…. пропускали ток (I)… в течение (t)…. Вычислить объем газа (при н.у.), выделившегося на аноде (Pt). Выход вещества на аноде принять за 100%.
| № варианта | раствор | I, A | t, мин |
| 11. | HCl | 1,2 | |
| 12. | K2SO4 | 0,8 | |
| 13. | H2SO4 | 0,6 | |
| 14. | AlCl3 | 1,5 | |
| 15. | KNO3 | 0,8 | |
| 16. | NaF | 0,4 | |
| 17. | H2O | ||
| 18. | KCl | 0,2 | |
| 19. | KOH | 1,4 | |
| 20. | NaCl | 0,5 | |
| 21. | Al2(SO4)3 | 0,6 | |
| 22. | H2O | 0,9 | |
| 23. | H2SO4 | 1,0 | |
| 24. | NaCl | 0,6 | |
| 25. | BaCl2 | 1,2 |
