Тема 2 Основные классы неорганических веществ

Простые вещества– их молекулы состоят из одного вида атомов. Подразделяют на металлы (например: K, Mg, Ni, Fe, Zn, Al, Cr, Ag, Cu) и неметаллы (S, P, N2, O2, O3, Br2).
Сложные вещества – их молекулы состоят из атомов нескольких видов.
Оксиды – сложные вещества, их молекулы состоят из двух видов элементов, одним из которых кислород.
Основные оксиды – оксиды типичных металлов со степенями окисления +1 и +2, иногда +3, которым в качестве гидроксидов соответствуют основания:
- +1: K2O, Li2O, Na2O, Rb2O, Cs2O, Cu2O, Ag2O, Tl2O;
- +2: CaO, BaO, SrO, MnO, FeO, MgO, NiO, TiO;
- +3: Bi2O3, La2O3, Ti2O3.
- Взаимодействуют с водой с образованием щелочей: СаО+Н2О=Са(ОН)2;
с кислотами MgO + H2SO4 = MgSO4 + H2O;
с кислотными оксидами ВаО + СО2 = ВаСО3.
Кислотные оксиды – это оксиды неметаллов (например, P2O5, B2O3, Cl2O7) и некоторых металлов в высшей степени окисления (например, Nb2O5, MoO3, Mn2O7), которым в качестве гидроксидов соответствуют кислоты.
Взаимодействуют с водой с образованием кислот P2O5 + 3H2O = 2H3PO4;
со щелочами СО2 + Ва(ОН)2 = ВаСО3 + Н2О;
с основными оксидами СаО + СО2 = СаСО3.
Амфотерными оксиды, которым в качестве гидроксидов соответствуют амфотерные гидроксиды – это оксиды металлов со степенями окисления:
+2: BeO, ZnO, SnO, PbO, CuO, GeO;
+3: Al2O3, Sb2O3, Cr2O3, Fe2O3, Ga2O3;
+4: SnO2, PbO2, GeO2.
Реагируют с кислотными оксидами и кислотами, проявляя основные свойства PbO+2HNO3=Pb(NO3)2+H2O
ZnO+SiO2=ZnSiO3;
с основными оксидами и щелочами, проявляя кислотные свойства ZnO+CaO=CaZnO2
Al2O3+2NaOH=2NaAlO2+H2O,
в растворе Al2O3+2NaOH+3H2O=2Na[Al(OH)4].
Гидроксиды– соединения оксидов химических элементов с водой,
СаО + H2O = Са(ОН)2
SO3 + H2O = H2SO4
Основные гидроксиды (основания)– состоят из катиона металла или аммония NH4+ и гидроксильной группы ОН–.
Например: NaOH, Ni(OH)2, Mg(OH)2, Bi(OH)3, NH4OH.
Щелочи – сильные основания, как правило, хорошо растворимые в воде, гидроксиды щелочных и щелочноземельных металлов (металлов I и II главных групп).
Например: NaOH, КОН, Ва(ОН)2 раствор Са(ОН)2.
Взаимодействуют: с кислотами Ba(OH)2 + 2HCl = BaCl2 + 2H2O;
с амфотерными гидроксидами Al(OH)3 + NaOH = Na[Al(OH)4]
с кислотными оксидами СаO2+ СO= СаСO3
с амфотерными оксидами Al2O3+Ca(OН)2= Ca(AlO2)2 +H2O
Амфотерные гидроксиды(амфотерные основания)– гидроксиды, проявляющие в химических реакциях в зависимости от условий и основные и кислотные свойства, т.е. обладающие двойственной природой.
Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Ge(OH)2, Cu(OH)2;
Al(OH)3, Cr(OH)3, Sb(OH)3, Ga(OH)3, Au(OH)3, As(OH)3;
Sn(OH)4, Pb(OH)4, Ge(OH)4.
Амфотерные гидроксиды могут быть получены взаимодействием солей амфотерных металлов со щелочью. AlCl3+3NaOH=Al(OH)3+3NaCl
Следует помнить, что в избытке щелочи сразу образуются растворимые комлексные соли AlCl3 + 4NaOH= Na[Al(OH)4] + 3NaCl– тетрагидроксоалюминат натрия
AlCl3 + 6NaOH= Na3[Al(OH)6] + 3NaCl – гексагидроксоалюминат натрия
Амфотерные гидроксиды взаимодействуют с кислотами, проявляя основные свойства, формула гидроксида записана в виде основания:
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Амфотерные гидроксиды взаимодействуют со щелочами, проявляя кислотные свойства, формула гидроксида записана в виде кислоты H3AlO3, амфотерный металл в составе аниона:
в расплаве: H3AlO3 + NaOH = NaAlO2 + 2H2O
в растворе: Al(OH)3 + NaOH = Na[Al(OH)4] или
Al(OH)3 + 3NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Zn(OH)3 + 2NaOH = Na2[Zn(OH)4]
Кислотные гидроксиды (кислородсодержащие кислоты) – гидроксиды, которые проявляют кислотные свойства, являются кислотами.
Кислоты – соединения, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков (анионов кислот). Основность кислоты – это число атомов водорода, способных замещаться на металл: одно- (HCl, HNO3), двух- (H2SO3, H2S), трех- (H3PO4) основные.
Кислоты подразделяются на безкислородные (например, HCl) и кислородсодержащие (кислотные гидроксиды, например, H2SO4).
По химической активности (силе) кислоты делят на сильные (HCl, H2SO4) и слабые (H2SO3, СH3СООН).
Таблица 1
Названия кислот и их анионов
| Кислоты | Анионы кислот | ||
| Бескислородные кислоты | |||
| Хлороводородная | HCl | Cl- | Хлорид |
| Фтороводородная | HF | F- | Фторид |
| Бромоводородная | HBr | Br-- | Бромид |
| Иодоводородная | HI | I- | Иодид |
| Сероводородная | H2S | S2- | Сульфид |
| HS- | Гидросульфид | ||
| Циановодородная | HCN | CN- | Цианид |
| Родановодородная | HCNS | CNS- | Роданид |
| Кислородсодержащие кислоты | |||
| Азотная | HNO3 | NO3- | Нитрат |
| Азотистая | HNO2 | NO2- | Нитрит |
| Ортофосфорная | H3PO4 | H2PO4- | Дигидрофосфат |
| HPO42- | Гидрофосфат | ||
| PO43- | Фосфат | ||
| Серная | H2SO4 | HSO4- | Гидросульфат |
| SO42- | Сульфат | ||
| Сернистая | H2SO3 | HSO3- | Гидросульфит |
| SO32- | Сульфит | ||
| Тиосерная | H2S2O3 | S2O32- | Тиосульфат |
| Хлорная | HClO4 | ClO4- | Перхлорат |
| Хлорноватая | HClO3 | ClO3- | Хлорат |
| Хлористая | HClO2 | ClO2- | Хлорит |
| Хлорноватистая | HСlO | СlO- | Гипохлорит |
| Угольная | H2CO3 | HCO3- | Гидрокарбонат |
| CO32- | Карбонат | ||
| Кремниевая | H2SiO3 | SiO32- | Силикат |
| Марганцовистая | H2MnO4 | MnO42- | Манганат |
| Марганцевая | HMnO4 | MnO4- | Перманганат |
| Хромовая | H2CrO4 | CrO42- | Хромат |
| Двухромовая | H2Cr2O7 | Cr2O72- | Бихромат |
| Муравьиная | HCOOH* | HCOO- | Формиат |
| Уксусная | CH3COOH* | CH3COO- | Ацетат |
| Щавелевая | HOOCCOOH* | C2O42- | Оксалат |
*Муравьиная, уксусная и щавелевая кислоты являются органическими кислотами, поэтому вид их формул отличается от вида минеральных (неорганических) кислот. Водород, имеющий кислые свойства и способный замещаться на ион металла, занимает в минеральных кислотах первое место (H2SO4), в органических – последнее (HCOOH, CH3COOH,НООССООН).
Кислоты взаимодействуют
с основными гидроксидами Ba(OH)2 + 2HCl = BaCl2 + 2H2O;
с амфотерными гидроксидами Al(OH)3 +3HNO3 = Al(NO3)3 + 3H2O;
с основными оксидами MgO+2HCl=MgCl2+H2O;
амфотерными оксидами Cr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O;
с металлами, стоящими в ряду напряжений до водорода Fe+H2SO4=FeSO4+H2↑.
Не взаимодействуют с металлами, стоящими за водородом: Cu, Hg, Ag, Au;
При взаимодействии с металлами HNO3 и H2SO4 (конц.) окислителями являются S+6 и N+5. Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O;
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
Соли – продукты полного или неполного замещения водорода кислоты на металл, или замещения гидроксигрупп основания кислотным остатком.
Средние соли (NaCl, Na2SO4, K3PO4),
Кислые соли (NaHCO3, MgHPO4, КH2PO4),
Основные соли (FeOHCl, Al(OH)2Cl, (CaOH)2CO3,
Двойные соли (KAl(SO4)2),
Комплексные соли (Ag[(NH3)2]Cl, K4[Fe(CN)6]).
Характерные реакции и генетическая связь неорганических соединений разных классов представлены в Таблицах, для реакций, протекающих в растворе, кроме молекулярных уравнений приведены полные и краткие ионные уравнения. Понятия растворимость и сила оснований и кислот, двойственная природа амфотерных гидроксидов рассмотрены в главе Диссоциация.
Таблица 2
Генетическая связь между соединениями разных классов
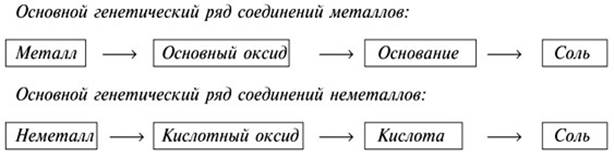
Таблица 3
