Биологическое значение осмотического давления
Осмос имеет большое значение для растительных и животных организмов, способствуя достаточному оводнению клеток и межклеточных структур. Возникающее при этом осмотическое давление обусловливает тургор клеток.
Каждая живая клетка имеет оболочку или поверхностный слой протоплазмы, обладающие свойством полупроницаемости. Помещая животные или растительные клетки в дистиллированную воду, можно наблюдать перемещение воды внутрь клеток, что ведет к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Подобное разрушение клеток путем разрыва их оболочек (или поверхностных слоев протоплазмы) называют лизисом, а в случае эритроцитов – гемолизом.
В крепких растворах солей отмечается, наоборот, сморщивание клеток (плазмолиз), обусловленное потерей воды, перемещающейся из них в более концентрированный внешний раствор.
Растворы с осмотическим давлением, равным давлению раствора, взятого за стандарт, называются изотоническими (изоспо-гречески равный). Растворы с осмотическим давлением более высоким, чем в стандарте, называются – гипертоническими, с меньшим давлением – гипотоническими.
Осмотические давление биологических жидкостей в различных организмах неодинаково: так, осмотическое давление крови у лягушек несколько ниже, чем у человека, а у некоторых морских животных, обитающих в воде со значительным содержанием солей, оно выше. У растений, а также у многих морских животных и акуловых рыб осмотическое давление тканевых жидкостей в определенной степени меняется в зависимости от осмотического давления внешней среды.
Более высокоорганизованные животные имеют постоянное осмотическое давление крови, независящее от внешней среды. Постоянство этого показателя называют изоосмией. Нарушение изоосмии оказывается губительным для организма гораздо раньше, чем наступает плазмолиз или лизис клеток. Понижение осмотического давления введением больших избытков воды или в результате интенсивной потери солей, например с потом, вызывает рвоту, судороги, затемнение сознания и т.п., вплоть до гибели организма. Повышение же осмотического давления путем введения больших количеств воды. Вода скапливается в тех тканях, в которых откладывается избыточное количество солей, что вызывает их отеки (в первую очередь подкожной клетчатки); в то же время обезвоживание слизистых оболочек обусловливает чувство жажды, нарушает нормальную деятельность нервной системы и других жизненно важных органов.
В организм человека и животных можно вводить в больших количествах только изотонические растворы. Такие растворы вводят больным после тяжелых операций для возмещения потерь жидкости с кровью. При хирургических операциях извлеченные из брюшной полости петли кишок предохраняют от высыхания, обкладывая их марлевыми салфетками, смоченными физиологическим раствором.
В клинической практике применяются гипертонические растворы. небольшое количество их вводят внутривенно, например при глаукоме, характеризующейся повышенным внутриглазным давлением, чтобы «оттянуть» избыточное количество влаги из передней камеры глаза.
В хирургии широко применяют гипертонические повязки, представляющие собой марлевые полоски, смоченные в гипертонических растворах NaCl и введенные в гнойные раны; согласно законам осмоса ток раневой жидкости направляется по марле наружу, что способствует постоянному очищению раны от гноя, микроорганизмов, продуктов распада и пр.
Используемые в качестве слабительных средств плохо всасывающиеся в желудочно-кишечном тракте соли MgSO4 и Na2SO4 применяют также в виде гипертонических растворов. Это вызывает переход больших количеств воды из слизистой оболочки в просвет кишечника, что способствует послабляющему действию сульфатов.
Создание изоосмической (изотонической) среды совершенно необходимо при экспериментальных исследованиях на выделенных из организма органах и тканях.
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ.
Растворам электролитов присущи все основные свойства растворов неэлектролитов. Однако, в растворах электролитов отсутствует та пропорциональность между молярной концентрацией и осмотическим давлением, повышением температуры кипения и т.п., которая была установлена для растворов неэлектролитов.
В растворах электролитов осмотическое давление и температура кипения выше, а температура замерзания ниже, чем следовало бы ожидать исходя из молярной концентрации. Причина этих отклонений заключается в диссоциации электролитов, в результате чего в растворах оказывается большее число кинетически активных частиц (сумма молекул и ионов), чем в эквимолярных растворах неэлектролитов.
Чтобы законы, применяемые для электролитов, можно было использовать и для растворов неэлектролитов, Вант-Гофф ввел поправку – коэффициент i. Коэффициент Вант-Гоффа показывает, во сколько раз истинная концентрация кинетически активных частиц и, следовательно, осмотическое даление, понижение температуры замерзания, понижение давления пара, повышение температуры кипения в растворе электролита больше, чем в эквимоляльном растворе неэлектролита:
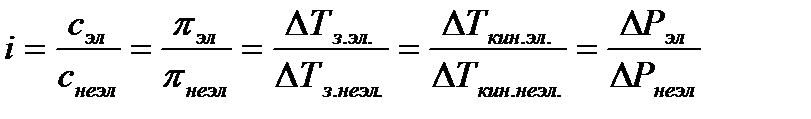
Величина связана со степенью диссоциации электролита следующим соотношением:
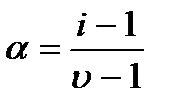
υ – количество ионов, на которое диссоциирует одна молекула электролита.
Используя коэффициент i, можно применять закон Рауля, его следствия и законы осмотического давления к растворам электролитов:
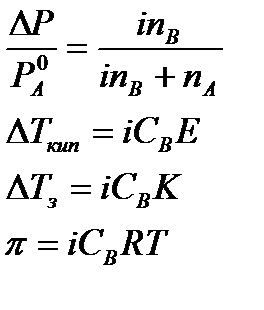
При одинаковой температуре растворы электролитов, содержащие равные количества частиц (молекул и ионов) в единице объема растворителя, изотоничны. Из двух растворов электролитов с одинаковой молярной концентрацией осмотическое давление будет выше в растворе электролита с более высокой степенью диссоциации. При одинаковой степени диссоциации в растворе электролита, диссоциирующего на большее число ионов, осмотическое давление будет выше.
Изучение коллигативных свойств разбавленных растворов электролитов и неэлектролитов привело к формированию физической теории растворов.
При подготовке к занятию необходимо, используя конспект лекций, а также указанные учебные пособия, подготовить следующие вопросы:
1. Какие растворы называются идеальными, предельно разбавленными и неидеальными?
2. Какие способы выражения концентраций называются моляльностью и моляльной долей?
3. Что называется равновесным давлением насыщенного пара над жидкостью? Зависит ли оно от температуры?
4. Сформулируйте закон и следствия из закона Рауля.
5. Объясните, почему температура замерзания раствора ниже, а температура кипения раствора выше, чем у чистого растворителя?
6. напишите уравнение криометрии и эбулиометрии и обоснуйте данные зависимости.
7. В чем заключается физический смысл криоскопической и эбуллиоскопической постоянных
8. Какое явление называют осмосом и каков его механизм?
9. Что называется осмотическим давлением и какие факторы его определяют?
10. Напишите математическое выражение закона Вант-Гоффа и дайте его определение.
11. Какие свойства растворов относятся к коллигативным и для решения каких вопросов их используют.
12. Как отличаются коллигативные свойства разбавленных растворов электролитов от идентичных свойств растворов неэлектролитов и почему?
13. В чем заключается физический смысл изотонического коэффициента?
14. Записать уравнение криометрии и эбулиометрии применительно к разбавленным растворам слабых и сильных электролитов.
15. В чем заключается биологическая значимость изучаемых вопросов?
