Изучение свойств кислот, оснований и солей
В СВЕТЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Цель: закрепить знания о свойствах электролитов, развивать умение исследовать свойства веществ, анализировать результаты химического эксперимента, делать выводы, следующие из проведенных экспериментальных исследований.
Оборудование: пробирки, рН-шкала, индикаторная бумага.
Реактивы: железный гвоздь, медь, цинк; соляная кислота, карбонат кальция, растворы карбоната натрия, сульфата калия, гидроксида натрия, хлорида железа (III), хлорида бария, сульфата меди (II), хлорида натрия, нитрата серебра, серной кислоты, индикаторов.
G Соблюдайте правила техники безопасности!
Ход работы
I. Изучение свойств кислот
Задание 1. Взаимодействие кислот с металлами и солями
1. Исследуйте, с какими из предложенных веществ (медь, цинк, карбонат натрия, сульфат калия, нитрат серебра, хлорид бария – взаимодействует соляная кислота. Результаты исследований занесите в таблицу 1.
Задание 2. Реакция нейтрализации
1. При помощи универсальной индикаторной бумаги определите рН в растворе серной кислоты (< 7 или >7). К раствору добавьте примерно такой же объем гидроксида натрия и определите рН еще раз. Как изменилась концентрация ионов водорода в растворе после добавления щелочи?
______________
Удалось ли вам нейтрализовать кислоту щелочью? ___________________________
Почему? _______________________________
Какое вещество осталось в избытке? _______
2. Если в избытке осталась кислота, то попробуйте ее нейтрализовать такой же порцией щелочи и опять определите значение рН.
3. Заполните таблицу 2.
4. Сделайте вывод.
__________________
| Вещество | Наблюдения | Уравнение реакции |
| Цинк | ||
| Медь | ||
| Карбонат натрия _______ | ||
| Сульфат калия _________ | ||
| Нитрат серебра ________ | ||
| Хлорид бария |
| Задание | Наблюдения | Уравнение реакции |
| 1. К раствору серной кислоты добавьте примерно такой же объем гидроксида натрия и определите рН | ||
| 2. Нейтрализация избытка серной кислоты раствором гидроксида натрия |
II. Изучение свойств щелочей
Задание 1. Взаимодействие щелочей с солями.
1. В пробирку налейте раствор гидроксида кальция объемом 1 – 2 см3. И прилейте к нему примерно такой же объем карбоната натрия. Заполните таблицу 3.
Таблица 1
| (в молекулярном и ионном виде) | Вывод |
Таблица 2
| (в молекулярном и ионном виде) | Вывод |
2. Составьте уравнение реакции. Заполните таблицу 3.
Задание 2. Взаимодействие щелочей с солями с образованием нерастворимых оснований.
1. В пробирку с раствором хлорида железа (III) по каплям прибавляйте раствор гидроксида натрия до появления признаков реакции. Наблюдения занесите в таблицу 3.
| Задание | Наблюдения | Уравнение реакции |
| 1. Взаимодействие щелочей с солями | ||
| 2. Взаимодействие щелочей с солями с образованием нерастворимых оснований |
Вывод: ______________
III. Изучение свойств солей
Задание. Взаимодействие солей со сложными веществами
1. Проведите химические реакции, позволяющие осадить катионы металла и анионы кислотного остатка, которые содержатся в растворе сульфата меди (II).
| Задание | Наблюдения | Уравнение реакции |
| 1. Разделите выданный вам раствор сульфата меди (II). В первую пробирку добавьте небольшое количество раствора гидроксида натрия | ||
| 2. Во вторую пробирку с раствором сульфата меди (II) добавьте немного раствора хлорида бария |
2. Составьте уравнение реакции в молекулярном и ионном виде. Запишите в таблицу 3.
3. Сделайте вывод о свойствах щелочей как электролитов с учетом результатов выполнения заданий по изучению свойств кислот.
Таблица 3
| (в молекулярном и ионном виде) | Вывод |
2. Составьте уравнения реакций в молекулярном и ионном виде.
3. Заполните таблицу 4.
4. Сделайте вывод с помощью каких реакций можно осадить катионы меди (II) и сульфат-анионы из раствора сульфата меди (II).
_____________________
| (в молекулярном и ионном виде) | Вывод |
Практическая работа №3 «___» ____________________20___г.
РЕШЕНИЕ ЭКСПЕРИМЕНАТЛЬНЫХ ЗАДАЧ
ПО ТЕМЕ «НЕМЕТАЛЛЫ»
Цель:закрепить знания о свойствах неметаллов, развивать умение исследовать свойства веществ, анализировать результаты химического эксперимента, делать выводы, следующие из проведенных экспериментальных исследований.
Оборудование: пробирки, спиртовка, держатель для пробирок.
Реактивы: рН-шкала, универсальная индикаторная бумага; соляная кислота, сульфат натрия, карбонат натрия; растворы карбоната натрия, сульфата натрия, гидроксида натрия, хлорида бария, серной кислоты, нитрата серебра, фенолфталеин.
G Соблюдайте правила техники безопасности!
| Номер пробирки | Реактив | Наблюдения | Уравнение реакции |
| Соляная кислота | |||
| Хлорид бария | |||
| Окрашивание пламени сухой солью | |||
| Соляная кислота | |||
| Хлорид бария | |||
| Окрашивание пламени сухой солью |
Ход работы
Задача 1
В пронумерованных пробирках находятся карбонат натрия и сульфат натрия. При помощи качественных реакций определите выданные вам вещества.
Перед началом работы проверьте выданные вам соли на растворимость в воде. Затем проведите качественные реакции на ионы, находящиеся в растворе.
Результаты исследований занесите в таблицу 1, указав признаки химических реакций. Составьте уравнения соответствующих реакций в молекулярном и ионном виде. Если реакция не возможна, в соответствующей графе поставьте прочерк.
Таблица 1
| (в молекулярном и ионном виде) | Вывод (название и формула вещества) |
Задача 2
Проведите реакции, позволяющие доказать качественный состав серной кислоты. Исследуйте рН раствора. Составьте уравнения реакции определения сульфат-иона в растворе. Результаты исследований занесите в таблицу 2.
| Определяемый ион | Качественный реактив | Наблюдения | Уравнение реакции |
| Катион Н+ | |||
Анион 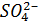 |
Задача 3
1) Нейтрализуйте выданный вам раствор гидроксида натрия раствором соляной кислоты (в присутствии индикатора фенолфталеина). Составьте уравнение химической реакции в молекулярном и ионном виде. Результаты занесите в таблицу 3.
| Задание | Наблюдения | Уравнение реакции |
| Нейтрализуйте раствор гидроксида натрия раствором соляной кислоты в присутствии фенолфталеина. |
2) Рассчитайте, хватит ли раствора соляной кислоты массой 60 г с массовой долей HCl 10% для нейтрализации гидроксида натрия в растворе 70 г с массойвой долей NaOH 5%.
| Дано: т р-ра HCl = 60 г ω (HCl) = 10 % m р-ра (NaOH) = 70 г ω (NaOH) = 5% | Решение: m (HCl) = m (NaOH) = |
| п (HCl) - ? | M (HCl) = Mr (HCl) = |
n (HCl) =
M (NaOH) = Mr (NaOH) =
n (NaOH) =
Таблица 2
| (в молекулярном и ионном виде) | Вывод |
Таблица 3
| (в молекулярном и ионном виде) | Вывод |
Записываем уравнение химической реакции. По уравнению определяем химическое количество вещества соляной кислоты, необходимое для нейтрализации рассчитанного количества гидроксида натрия.
Сравниваем химическое количество вещества соляной кислоты, необходимое для нейтрализации гидроксида натрия, с химическим количеством, данным по условию и отвечаем на вопрос задачи.
Сделайте вывод о свойствах неметаллов:
Задача 4.
К раствору массой 200 г с массовой долей HCl 7,3% добавили 150 г раствора, содержащего 8% гидроксида натрия. Рассчитайте химические количества исходных веществ и массу образовавшейся соли.
_____________________________
Практическая работа № 4 «____» ________________ 20___ г.
