Внутренняя энергия системы. первый закон термодинамики
Существует два основных типа энергии - кинетическая (обусловленная движением тела) и потенциальная (обусловленная положением тела или его частей в пространстве). Эти два типа энергии проявляются в различных формах, например, в виде тепловой (теплота), световой (энергия излучения), химической, электрической энергии или в других формах.
Согласно закону сохранения энергии, энергия не создается из ничего и не уничтожается, а может передаваться от одного тела к другому или превращаться из одной формы в другую. Следовательно, если в течение процесса исчезает энергия определенного вида, то взамен появляется эквивалентное количество энергии другого вида. Применим представления о сохранении энергии к химическим системам.
Рис. 4.1. Виды механического движения.
Атомы, молекулы или ионы, составляющие химическую систему, обладают кинетической и потенциальной энергией. Кинетическая энергия обусловлена движением частиц. Это движение может быть поступательным, вращательным и колебательным (рис.4.1).
Одним из видов кинетической энергии является теплота, так как она связана с движением атомов и молекул. Потенциальная энергия частиц обусловлена их взаимодействием между собой. Например, электроны в атоме обладают потенциальной энергией по отношению к положительным зарядам в его ядре. Энергия связи - тоже одна из форм потенциальной энергии. Разрыв и образование химических связей сопровождаются изменением потенциальной энергии, так как химические связи в продуктах реакции и в исходных веществах могут существенно отличаться.
Сумма потенциальной и кинетической энергий всех частиц в системе (кроме кинетической и потенциальной энергий системы как целого) называется внутренней энергией системы (U). Абсолютное значение U не может быть определено, так как нельзя привести систему в состояние, лишенное энергии.
Внутренняя энергия является функцией состояния системы, поэтому ее изменение (DU) определяется выражением:
| DU = U2 – U1 | (4.3). |
Изменение внутренней энергии системы происходит при передаче энергии системе или от нее. Существует два основных способа передачи энергии - это передача теплоты и выполнение работы. Передача энергии, вызываемая разностью температур между системой и ее окружением или между одной системой и другой системой, называется передачей теплоты. Количество энергии, передаваемое таким образом, обозначается буквой Q (Дж) и равно:
| Q = m·Cm·DT , | (4.4). |
где m - масса системы (кг),
DT - изменение температуры (K),
C - удельная теплоемкость вещества, из которого состоит система (Дж/(кг·K)).
Теплота не является свойством системы, поэтому не может быть и функцией состояния системы.
Другой формой передачи энергии является работа - W (Дж). Существуют различные виды работы. В химии работа чаще всего связана с расширением системы. Такое расширение происходит при выделении газа в ходе реакции. В этом случае работа, выполняемая системой, определяется выражением:
| W = p·DV = p·(V2 – V1) | (4.5). |
где P - внешнее давление (Па), для многих химических реакций внешнее давление равно атмосферному;
DV = V2 – V1 - изменение объема системы (м3).
Таким образом, изменение внутренней энергии (DU) закрытой системы равно разности сообщаемой системе теплоты Q и совершаемой ею при этом работы, т.е.
| DU = Q – W | (4.6). |
Полученное соотношение называется первым законом термодинамики. Этот закон представляет собой одну из формулировок закона сохранения энергии, так как показывает, что изменение внутренней энергии системы (DU) связано только с передачей энергии системе или от нее.
ТЕРМОХИМИЯ
4.4.1. ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ. ЭНТАЛЬПИЯ
Обычно химические реакции сопровождаются тепловыми эффектами. Тепловым эффектом называется суммарное количество энергии, выделенной или поглощенной системой в результате реакции, проводимой при постоянной температуре. Раздел химии, который изучает тепловые эффекты химических реакций и фазовых превращений, называется термохимией.
Согласно первому закону термодинамики (уравнение 4.6) количество выделенной или поглощенной системой теплоты Q определяется равенством:
Q = DU + W.
Подставив выражение (4.5) в (4.6), получим равенство:
| Q = DU + p·DV, | (4.7). |
определяющее тепловой эффект химической реакции. Из равенства (4.7) следует, что тепловой эффект реакции зависит от того, в каких условиях она протекает. В изохорном процессе V = const, DV = 0, следовательно, тепловой эффект реакции QV равен изменению внутренней энергии системы:
| QV = U2 – U1 = DU, т.к. W = 0 | (4.8). |
В изобарном процессе p = const, следовательно, тепловой эффект реакции Q равен:
QP = DU + p·DV = (U2 – U1) + p·(V2 – V1) = (U2 + p·V1) - (U1 + p·V1).
Обозначим:
| U + p·DV = H | (4.9). |
Величина H называется энтальпией или теплосодержанием системы. Поэтому тепловой эффект химической реакции при изобарном процессе равен изменению энтальпии системы:
| QP = H2 – H1 = DH | (4.10). |
| или QP = DU + p·DV = DH | (4.10а). |
Энтальпия, также как и внутренняя энергия, является термодинамической функцией состояния системы.
Для реакций, в которых участвуют только твердые и жидкие вещества, член p·DV в уравнении (4.10а) пренебрежимо мал или равен нулю. Для подобных реакций выполняется соотношение DH » DU. Для газофазных реакций, протекающих с участием газообразных веществ, изменение объема значительно. Если DV > 0, т.е. происходит расширение, то DH > DU; если DV < 0, т.е. происходит сжатие, то DH < DU. Произведение p·DV для таких реакций можно рассчитать из уравнения идеального газа:
p·DV = n·R·T или
p·DV = Dn·R·T,
где Dn - изменение числа моль газа, определяемое из уравнения реакции; например,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O , Dn = 5.
Химические реакции, протекающие с выделением теплоты, называются экзотермическими. При этом в изохорном процессе внутренняя энергия системы уменьшается, т.е. DU < 0 (т.к. U2 < U1), а в изобарном процессе - энтальпия уменьшается, т.е. DH < 0 (т.к. H2 < H1) (рис.4.2).
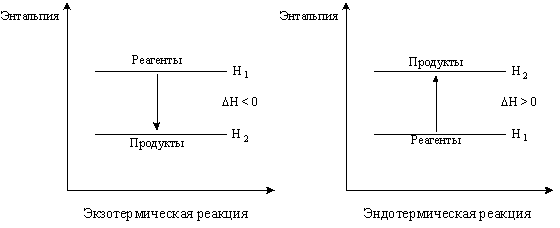
Рис. 4. 2. Изменение энтальпии системы: а) в экзотермической; б) эндотермической реакциях.
Химические реакции, протекающие с поглощением теплоты, называются эндотермическими. При этом в изохорном процессе DU > 0, в изобарном процессе - DH > 0. Уменьшение энтальпии в экзотермических процессах означает, что суммарная энергия, содержащаяся в продуктах реакции в виде энергии химических связей, межмолекулярных взаимодействий, молекулярных колебаний и т.д. меньше суммарной энергии исходных веществ (реагентов). И наоборот, увеличение энтальпии в эндотермических процессах означает, что суммарная энергия, содержащаяся в продуктах реакции больше суммарной энергии исходных веществ.
Изменение энтальпии при стандартном состоянии веществ, участвующих в реакции или при фазовом превращении, обозначается DH°(T) и DH°(298 K), если температура системы T или 298,15 K.
Тепловые эффекты химических реакций зависят не только от условий (температура, давление, объем), в которых они протекают, но и от количества веществ, участвующих в реакции, и их физического состояния. Поэтому для того, чтобы можно было сравнивать энергетические эффекты различных процессов, их характеризуют изменением энтальпии при стандартных условиях, соответствующим конкретному уравнению химической реакции. Уравнения химических реакций, в которых указаны их тепловые эффекты и агрегатные состояния (г-газовое, ж-жидкое, к-кристаллическое, т-твердое) или аллотропные модификации (например, a-сера, b-сера) веществ, называются термохимическими уравнениями реакций. Например:
2H2(г) + O2(г) = 2H2O(ж) , DH°(298 K) = -571,6 кДж
2H2(г) + O2(г) = 2H2O(г) , DH°(298 K) = -483,6 кДж
4.4.2. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
Тепловые эффекты химических реакций можно определить экспериментально или расчетным путем. Измерение тепловых эффектов называется калориметрией. В основе термохимических расчетов лежит закон, сформулированный русским ученым Г.И. Гессом (1840 г.):
