Раздел №1. Строение вещества
Тема 1. СТРОЕНИЕ АТОМА.
Тема 2. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ.
Пример 1. Описать свойства атома индия и его положение в периодической системе элементов.
Решение. Так как Z=49, заряд ядра атома Jn и общее количество электронов равны 49. Зная, что свойства атома определяет структура его валентных электронов, начнем с ее построения. Индий находится в 5 периоде III А группы, отсюда его валентные электроны имеют следующую структуру: 5s25p1.
Наличие трех электронов на внешнем уровне и большой радиус атома (n =
5) предполагают достаточную легкость отдачи электронов (небольшую энергию ионизации) и как следствие – металлические свойства и достаточно высокую химическую активность.
Пример 2. Какую валентность, обусловленную неспаренными электронами (спин-валентность), может проявлять фосфор в нормальном и возбужденном* состояниях?
 Решение. Распределение электронов внешнего энергетического уровня фосфора …3s23p3(учитывая правило Хунда, 3s23pх3pу3pZ) по квантовым ячейкам имеет вид: 15Р 3s23pх13pу13pZ3d
Решение. Распределение электронов внешнего энергетического уровня фосфора …3s23p3(учитывая правило Хунда, 3s23pх3pу3pZ) по квантовым ячейкам имеет вид: 15Р 3s23pх13pу13pZ3d
1 0
| ↑↓ | ↑ | ↑ | ↑ |
Атомы фосфора имеют свободные d – орбитали, поэтому возможен переход одного 3s – электрона в 3d – состояние:
15Р*3s13pх13pу13pZ13d1
| ↑ | ↑ | ↑ | ↑ | ↑ |
Отсюда валентность (спин-валентность) фосфора в нормальном состоянии равна трем, а в возбужденном – пяти.
 Пример 3. Укажите тип связей в молекулах F2, KCl, HCl. Приведите электронные модели их строения.
Пример 3. Укажите тип связей в молекулах F2, KCl, HCl. Приведите электронные модели их строения.
 Решение. 1. Молекула F2 состоит из двух одинаковых атомов фтора, поэтому ковалентная связь будет неполярной. Так как структура валентных электронов фтора …2s22p5, строение молекулы можно представить:
Решение. 1. Молекула F2 состоит из двух одинаковых атомов фтора, поэтому ковалентная связь будет неполярной. Так как структура валентных электронов фтора …2s22p5, строение молекулы можно представить:

или перекрыванием одноэлектронных р-р-орбиталей:

2. Молекула КСl состоит из двух резко отличающихся по электроотрицательности атомов металла (К) и неметалла (Сl), что определяет
ионный тип связи; К0 – ē → К+
Cl0+ ē → Cl-
К+ + Cl–→ КCl
3. Молекула НСl тоже состоит из двух разных атомов Н и Сl, поэтому в данном случае имеем ковалентную полярную связь, причем общая электронная пара смещена к более электроотрицательному атому хлора:
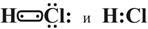
 При этом происходит перекрывание s-р – валентных орбиталей водорода и хлора:
При этом происходит перекрывание s-р – валентных орбиталей водорода и хлора:
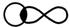

s – p
 Пример 4. Определите тип кристаллической решетки SiC и сделайте вывод о свойствах данного вещества.
Пример 4. Определите тип кристаллической решетки SiC и сделайте вывод о свойствах данного вещества.
Решение. Валентные электронные структуры кремния и углерода сходны (…3s23p2и …2s22p2), поэтому в результате перекрывания они образуют ковалентную связь (малополярную). Так как их насыщаемость в соединении высока (четыре связи), вещество является твердым и образует атомную кристаллическую решетку. А это влечет за собой высокую твердость вещества, его тугоплавкость, малую растворимость и диэлектрические свойства.
Контрольные вопросы
1. У какого из элементов – лития, цезия или бериллия – больше энергия ионизации? Сделайте вывод о химических свойствах их атомов, у какого элемента наиболее выражены металлические свойства?
2. Какой из элементов S или Se проявляют более выраженные окисли- тельные свойства? Почему?
3. Почему Cu, Ag, Au – это благородные металлы? Дайте объяснение их свойств на основе электронных структур и справочного материала.
4. Радиусы атомов Si и V равны (r=1,34 Ао), почему же так различны их свойства?
5. Почему Mn и Cl расположены в одной группе периодической системы, но в разных подгруппах? Дайте сравнительную характеристику свойств этих элементов на основе их электронных структур.
6. Какие типы связей проявляются в кристаллах следующих веществ: воды, метана, кремния, хлорида кальция, алюминия, оксида углерода (IV).
7. Почему свойства всех элементов II периода очень сильно отличаются от свойств элементов всех последующих периодов?
8. Пользуясь периодической системой, выясните, какие химические
элементы относятся к подгруппе азота. Выпишите их символы и названия. Приведите для каждого элемента электронную конфигурацию валентного слоя атома. Предскажите возможные степени окисления данных элементов.
9. Изобразите с помощью квантовых ячеек строение атомов кислорода и германия. Сделайте вывод об их химических свойствах. Приведите формулы гидроксидов этих элементов в высшей степени окисления.
10. Выделите валентные орбитали атомов кремния и ванадия. Сделайте вывод о химических свойствах этих атомов.
11. У какого из элементов As или Cl электроотрицательность выше? Почему? Сделайте вывод об их химических свойствах.
12. Составьте формулы водородных соединений азота и фосфора. В каком из этих соединений химическая связь более прочная? Какое из этих соединений и почему термически менее устойчиво?
13.  Укажите тип химической связи в молекулах N2, NaCl. Приведите схемы перекрывания их электронных облаков.
Укажите тип химической связи в молекулах N2, NaCl. Приведите схемы перекрывания их электронных облаков.
14.  Укажите тип химической связи в молекулах NН3, Н2О. Приведите электронные модели их строения.
Укажите тип химической связи в молекулах NН3, Н2О. Приведите электронные модели их строения.
15. Какую валентность, обусловленную неспаренными электронами, может проявлять свинец в нормальном и возбужденном состояниях? Сделайте вывод о химических свойствах соединений Pb с разной степенью окисления.
16.  Укажите тип кристаллической решетки в кристаллах Н2О, CsF. Сделайте вывод о свойствах этих кристаллов.
Укажите тип кристаллической решетки в кристаллах Н2О, CsF. Сделайте вывод о свойствах этих кристаллов.
17.  Почему Н2О – жидкость, а Н2S – газ? Сравните их tкип, tпл.
Почему Н2О – жидкость, а Н2S – газ? Сравните их tкип, tпл.
18. Определите тип связи молекул NaI и CH4. Сделайте вывод об их свойствах (прочность, реакционная способность, агрегатное состояние).
19.  У каких кристаллов: Н2О, SiO2, КСl, Li температура плавления наибольшая? Ответ обоснуйте.
У каких кристаллов: Н2О, SiO2, КСl, Li температура плавления наибольшая? Ответ обоснуйте.
20. Какой тип кристаллической решетки характерен для веществ с самой низкой температурой плавления? Ответ обоснуйте. Почему кислород и сера, имея в наружном слое одинаковое число электронов, проявляют разную валентность?
21. Проанализируйте валентные возможности атомов Be и Al в основном и возбужденном состояниях. Приведите формулы высших оксидов рассматриваемых элементов и предскажите их кислотно-основные свойства.
22.  Укажите, какие из перечисленных молекул являются полярными, а какие неполярными: СО2, Н2О, SO2, СН4. Ответ мотивируйте.
Укажите, какие из перечисленных молекул являются полярными, а какие неполярными: СО2, Н2О, SO2, СН4. Ответ мотивируйте.
23. Как изменяются химические свойства соединений марганца и характер
связей в них с увеличением степени окисления?
