Скорость химических реакций
Примеры решения задач
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
2NО (г) +О2 (г) ↔ 2NО2 (г), если объем газовой смеси уменьшить в три раза?
Решение. Обозначим концентрации реагирующих веществ: 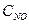 =а,
=а,  =b,
=b, 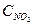 =с. Согласно закону действия масс скорости (v) прямой и обратной реакции до изменения объема
=с. Согласно закону действия масс скорости (v) прямой и обратной реакции до изменения объема
vпр.= kпр.а2b; vобр. = kобр.c2;
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза:  =За,
=За, 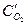 =3b,
=3b,  =3с. При новых концентрациях скорости (v’) прямой и обратной реакции:
=3с. При новых концентрациях скорости (v’) прямой и обратной реакции:
 = kпр. (За)2 (3b) = 27kпр.а2b;
= kпр. (За)2 (3b) = 27kпр.а2b;
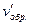 = kобр. (3с)2 = 9kобр.c2.
= kобр. (3с)2 = 9kобр.c2.
Отсюда  =
=  = 27;
= 27;  =
= 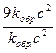 = 9.
= 9.
Следовательно, скорость прямой реакции увеличилась,. в 27 раз
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 50 до 70°С, если температурный коэффициент реакции равен 3.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
 =
=  ;
;
 =
=  =
=  = 9
= 9 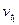 .
.
Следовательно, скорость реакции (  ), протекающей при температуре 70°С, увеличилась по сравнению со скоростью реакции (
), протекающей при температуре 70°С, увеличилась по сравнению со скоростью реакции ( 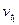 ), протекающей при температуре 50°С, в 9 раз.
), протекающей при температуре 50°С, в 9 раз.
Пример 3. Энергия активации реакции равна 33кДж/моль. Во сколько раз увеличится скорость реакции при нагревании реакционной смеси с 25 до 60оС?
Решение.Зависимость константы скорости химической реакции от температуры определяется уравнением Аррениуса:
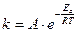 ,
,
где Еа - энергия активации реакции;
А - константа для данной реакции.
Записав выражения для констант скорости данной реакции k2 и k1 при температурах соответственно Т2 и Т1 и разделив первое уравнение на второе, получим: 
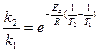 или
или 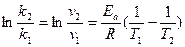
 отсюда
отсюда 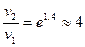 ,
,
т.е. скорость данной реакции увеличится в 4 раза.
Пример 4. Начальные концентрации исходных веществ в реакции
СН4 (г) +2Н2S(г) → CS2(г),+ 4H2(г)
были равны 0,3моль/л СН4 и 0,5моль/л Н2S. Найдите концентрации этих веществ в тот момент, когда образовалось 0,16 моль/л Н2. Как изменилась при этом скорость реакции?
Решение.По закону действия масс скорость данной реакции описывается уравнением:

Начальная скорость реакции равна:
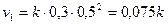 ,
,
где - константа скорости реакции, не зависящая от концентраций ее участников.
В начальный момент времени продукты реакции отсутствовали, т.е.начальные концентрации CS2 и H2 были равны 0. Расчет по уравнению реакции:
х у 0,16моль
СН4 (г) +2Н2S(г) → CS2(г),+ 4H2(г)
1моль 2моль 4моль
дает, что на образование 0,16 моль Н2 должно расходоваться
 и
и 

Поэтому к тому моменту, когда в системе образуется 0,16моль Н2, концентрации исходных веществ уменьшатся и составят:  и
и
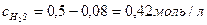
Соответственно, скорость реакции к этому моменту также уменьшится и будет равна:
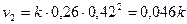
Отношение  , т.е. скорость реакции уменьшится в 1,6 раза.
, т.е. скорость реакции уменьшится в 1,6 раза.
Контрольные задания
121. При 509оС скорость реакции 2HI→ H2 + I2 составила 5,8·10-4 моль/(л∙мин). Вычислите концентрацию НI, если концентрации I2 равна 0,11 моль/л, а константа скорости реакции составляет 0,0047 л/(моль∙мин).
Ответ: 0,35 моль/л.
122. При увеличении температуры в системе на 45о скорость гомогенной реакции возросла в 65 раз. Вычислите температурный коэффициент скорости реакции. Как изменится скорость данной реакции при охлаждении реакционной смеси с 80 до 50оС?
Ответ: 2,5; в 15,625 раз.
123. Начальная концентрация исходных веществ в системе
4HI(г) +O2(г) →2I2(г) + 2H2О(г)
была равна 0,7 и 0,3 моль/л. Как изменится скорость реакции к тому моменту, когда концентрация I2 станет равна 0,2 моль/л?
Ответ: 44,4 раза
124. Как изменится скорость реакции, протекающей в системе:
MnO2(к) + 4HCl(г) → MnCl2(к) + Cl2(г)
при изменении давления в ней в 3 раза?
Ответ: 81 раз.
125. Как следует изменить давление в системе
2 NО(г) + Cl2(г) →2 NОCl(г);
чтобы скорость реакции возросла в 125 раз?
Ответ: 5 раз.
126. Энергия активации реакции равна 47,8 кДж/моль. Во сколько раз уменьшится скорость реакции при охлаждении реакционной смеси с 85 до 40оС?
Ответ: 10 раз.
127. Начальная концентрация соляной кислоты в реакции
СаСО3 (т) + 2HCl(раствор) →СаCl2(раствор) +СО2(г) + H2О(раствор)
равнялась 20%масс. Как изменится скорость данной реакции при снижении концентрации НСl до 15%масс.?
Ответ: 1,86 раз.
128. Скорость реакции при 40оС равна 0,085 моль/(л∙мин). При какой температуре следует проводить реакцию, чтобы ее скорость равнялась 0,60 моль/(л∙мин), если энергия активации данной реакции – 21,3 кДж/моль?
Ответ: 138оС.
129. Константа скорости реакции омыления уксусноэтилового эфира:
СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р)
равна 0,1 л/моль∙мин. Начальная концентрация уксусноэтилового эфира была равна
0,01 моль/л, а щелочи – 0,05 моль/л. Вычислите начальную скорость реакции и в тот момент, когда концентрация эфира станет равной 0,008 моль/л.
Ответ: 5,0∙10-5 и 3,84∙10-5 моль/л∙мин.
130. При повышении температуры с 55 до 85оС скорость гомогенной реакции возросла в 80 раз. Рассчитайте температурный коэффициент и энергию активации данной реакции.
Ответ: 4,3; 142,5 кДж/моль.
131. Как изменится скорость реакции
2H2S(г) +3O2(г) →2SO2(г) + 2H2О(г)
Если: а)уменьшить объем реакционной смеси в 2 раза?
б)увеличить концентрацию сероводорода в 3 раза?
Ответ: 32 раза; 9 раз.
132.Начальные концентрация исходных веществ в системе
N2(г) +3H2(г) ↔ 2NH3(г)
составили: азота – 2 моль/л, водорода – 4 моль/л. Как изменится скорость данной реакции при снижении концентрации водорода в результате реакции до 2,8 моль/л?
Ответ: 3,6 раза.
133. При повышении температуры с 40 до 75оС скорость гомогенной реакции возросла в 120 раз. Как изменится скорость данной реакции при повышении температуры с 75 до 100оС?
Ответ: 30,6 раз
134. Как следует изменить объем реакционной смеси системы:
8NH3(г) + 3Br2(ж)→6NH4Br(к) + N2(г),
чтобы скорость реакции увеличилась в 25 раз?
Ответ: 1,5 раз
135. При уменьшении температуры с 80 до 40оС скорость гомогенной реакции снизилась в 40 раз. Чему равна энергия активации реакции?
Ответ: 84,7 кДж/моль.
136.Константа скорости реакции 2SO2 + O2 → 2SO3 составляет 25 л2/(моль2∙мин). Исходные концентрации SO2 и О2, равны соответственно 0,27 и 0,09 моль/л. Найдите начальную скорость этой реакции и ее скорость в тот момент, когда концентрация O2 снизилась до 0,04 моль/л.
Ответ: 0,164 и 0,029 моль/л∙мин.
137. Исходные концентрации N2 и О2 в системе:
N2(г) +O2(г) → 2NО(г)
равны соответственно 0,06 и 0,02 моль/л. Как изменятся концентрации N2 и О2 к тому моменту, когда скорость реакции снизится в 4,5 раза по сравнению с исходной?
Ответ: 0,0465 и 0,0065 моль/л.
138. Как изменится скорость реакции
2С2Н2(г) + 3H2O(г) → С3Н6О(г) + СО2(г) + Н2(г)
при увеличении давления в системе в 4 раза?
Ответ: 1024 раза.
139. Как изменится скорость реакции
Н2О(г) + C(к) → Н2(г) + CO(г),
если: а) уменьшить объем реакционной смеси в 4 раза?
б) увеличить давление в системе в 5 раз?
Ответ: 4 раза; 5 раз.
140. Скорость реакции при 25оС равна 0,14 моль/(л∙мин), а при 50оС –
0,88 моль/(л∙мин). Какова энергия активации данной реакции ? Какой будет скорость данной реакции при 40оС?
Ответ:58,8кДж/моль; 0,44 моль/л∙мин.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Примеры решения задач
Пример 1. Константа равновесия гомогенной системы
СО (г)+Н2О (г) ↔СО2 (г)+Н2 (г)
при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: ( 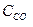 )исх.=З моль/л, (
)исх.=З моль/л, ( 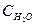 )исх.=2 моль/л.
)исх.=2 моль/л.
Решение.При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей называется константой равновесия данной системы и выражается через равновесные концентрации участников реакции следующим образом:
Кравн. = 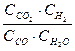
В условии задачи даны исходные концентрации тогда как в выражение Кравн. входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации (  )равн.== х моль/л. Согласно уравнению реакции:
)равн.== х моль/л. Согласно уравнению реакции:
х моль х моль х моль х моль
СО (г)+Н2О (г) ↔СО2 (г)+Н2 (г)
1моль 1моль 1моль 1моль
число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут:
(  )равн. = (
)равн. = (  )равн. = х моль/л;
)равн. = х моль/л;
( 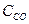 )равн. = (З — х) моль/л;
)равн. = (З — х) моль/л;
( 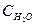 )равн. = (2 — х) моль/л.
)равн. = (2 — х) моль/л.
Зная константу равновесия, находим значение х, а затем и исходные концентрации всех веществ:
1 = 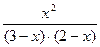 ,
,
Отсюда х = 1,2 моль/л. Таким образом, равновесные концентрации участников реакции:
(  )равн. = (
)равн. = (  )равн. =1,2 моль/л; (
)равн. =1,2 моль/л; ( 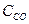 )равн. = (З — 1,2) = 1,8 моль/л;
)равн. = (З — 1,2) = 1,8 моль/л;
( 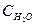 )равн. = (2 — 1,2) = 0,8 моль/л.
)равн. = (2 — 1,2) = 0,8 моль/л.
Пример 2. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
РСl5 (г) ↔РСl3 (г) + С12 (г);∆Hх.р. = + 92,59 кдж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РСl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье:
а) так как реакция разложения РСl5 эндотермическая (∆Нх.р.>0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление;
в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5 так и уменьшением концентрации РСl3 или С12.
Пример 3. Равновесие в системе H2(г)+ I2(г)↔ 2HI(г) установилось при следующих концентрациях участников реакции: HI – 0,05 моль/л, водорода и иода – по 0,01моль/л. Как изменятся концентрации водорода и иода при повышении концентрации HI до 0,08моль/л?
Решение. Зная равновесные концентрации участников реакции, можно рассчитать константу равновесия данной реакции:
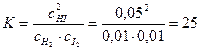 ;
;
При повышении концентрации HI до 0,08моль/л равновесие сместится в обратном направлении, т.е.более интенсивно начнет протекать обратная реакция
хмоль хмоль 2хмоль
H2(г)+ I2(г)↔ 2HI(г)
1моль 1моль 2моль
Если убыль HI к моменту достижения нового состояния равновесия принять равной 2х моль, то прирост концентраций Н2 и I2 к этому моменту составит х моль; подставив новые равновесные концентрации в выражение для константы равновесия, получим:
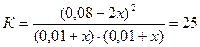 , откуда х = 0,004,
, откуда х = 0,004,
и новые равновесные концентрации Н2 и I2 составят (0,01+0,004) = 0,014 моль/л.
Контрольные задания
141. В каком направлении сместится равновесие системы
СО(г) + 3 Н2(г) ↔ СН4(г) + Н2О(г); ΔНо298<0
а) при повышении температуры; б) введении катализатора; в)понижении давления? Напишите выражение константы равновесия данной реакции.
142. Исходные концентрации монооксида углерода и водяного пара в системе:
СО + Н2О ↔ СО2 + Н2
составляли соответственно 0,09 и 0,03 моль/л. К моменту равновесия прореагировало
22% СО. Найдите равновесные концентрации остальных участников реакции и константу равновесия.
Ответ:0,02моль/л;0,07моль/л;0,01моль/л;0,57.
143. Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3(к) + 3 H2(г) ↔ 2 Fe(к) + 3 H2O(г) ; ΔНо298 = +98,6 кДж
В каком направлении сместится равновесие системы а) при уменьшении температуры;
б) увеличении концентрации водорода; в)понижении давления? Напишите выражение константы равновесия данной реакции.
144. При 509оС константа скорости прямой реакции H2(г)+ I2(г)↔ 2HI(г)
равна 0,16, а обратной - 0,0047. Напишите выражение для константы равновесия и рассчитайте ее значение.
Ответ: 34.
145. При 494оС константа равновесия реакции 2NО (г) +О2 (г) ↔ 2NО2 (г) равна 2,2. Равновесные концентрации NО и О2 соответственно равны 0,020 и 0,030 моль/л. Вычислите их исходные концентрации.
Ответ: 0,025 моль/л; 0,0325 моль/л.
146. Как повлияет на выход SO2 в системе:
SO3(г) + C(к) ↔ SO2(г) + CO(г)
а) уменьшение общего объема смеси; б) уменьшение концентрации SO3; в) введение катализатора?
147. Исходные концентрации SO2 и O2 в системе: 2SO2 + O2 ↔ 2SO3 составили соответственно 4 моль/л и 2 моль/л, исходное давление было равно 3,039∙105 Па. К моменту равновесия прореагировало 80% SО2. Найдите равновесные концентрации всех участников реакции, константу равновесия и давление в момент равновесия.
Ответ:3,2моль/л;0,8моль/л;0,4моль/л;40;2,23∙105 Па.
148. Исходная концентрация метана СН4 в системе СН4(г) ↔ С(к) + 2 Н2(г) составила 0,035 моль/л. К моменту равновесия прореагировало 80 % метана. Рассчитайте значение константы равновесия.
Ответ: 0,112.
149. Равновесие в системе N2(г) +3H2(г) ↔ 2NH3(г) установилось при следующих концентрациях участников реакции: N2 – 3 моль/л, H2 – 7 моль/л и NH3 – 3 моль/л. Как изменится концентрация остальных веществ при увеличении концентрации Н2 до 10моль/л?
Ответ: 4,44 и 2,28 моль/л.
150. Как изменится скорость прямой и обратной реакции в системе
2С2Н2(г) + 3H2O(г) → С3Н6О(г) + СО2(г) + Н2(г)
если уменьшить объем реактора в 2 раза? Повлияет ли это на равновесие в системе?
Ответ: 32 раза; 8 раз.
151. В каком направлении будет смещаться равновесие системы
2 СО2(г) ↔ 2 СО (г) + О2 (г) ; ΔНо298 = + 566 кДж
при: а) увеличении давления в системе; б) увеличении концентрации СO; в) введении катализатора; г) уменьшении температуры? Напишите выражение константы равновесия данной реакции.
152. Константа равновесия системы 2NО (г) +О2 (г) ↔ 2NО2 (г) равна при некоторой температуре 2,22, а начальная концентрация NО составила 4 моль/л. Какова должна быть начальная концентрация О2, чтобы доля окисленного NO составила 40%?
Ответ: 1,0 моль/л.
153.При каких условиях равновесие реакции
MnO2(к) + 4HCl(г) ↔ MnCl2(к) + Cl2(г)
будет смещаться в сторону образования Cl2? Напишите выражение константы равновесия данной реакции.
154. Константа равновесия реакции СО(г)+С12(г) ↔ СОСl2(г) равна 50. Равновесные концентрации СО и Cl2 составили соответственно 0,05 и 0,02 моль/л. Найдите равновесную концентрацию СОСl2 и исходные концентрации СО и Cl2.
Ответ: 0,05; 0,1 и 0,07 моль/л.
155. При некоторой температуре равновесные концентрации в системе
N2O4(г) ↔ 2NO2(г)
равны для N2O4 0,15 моль/л и для NO2 0,08 моль/л. Как изменится концентрация NO2 при понижении концентрации N2O4 до 0,10 моль/л?
Ответ: 0,065 моль/л.
156. Константа равновесия реакции СОСl2(г) ↔ СО(г)+С12(г) равна 0,02. Исходная концентрация СОCl2 составила 0,5 моль/л. Рассчитайте равновесную концентрацию Сl2. Какую исходную концентрацию СОCl2 следует взять, чтобы увеличить выход хлора в 2 раза?
Ответ: 0,18 моль/л; 1,8 моль/л.
157. Напишите выражение для константы равновесия гомогенной системы
СН4(г) + СО2(г) ↔ 2 СО(г) + 2 Н2(г) ΔНо298>0;
Как следует изменить температуру и давление, чтобы увеличить выход водорода? Как повлияет на величину выхода водорода увеличение концентрации СО?
158. Константа равновесия системы СCl4(г) ↔ 2Cl2 (г) +C (к) при температуре 700 К составляет 0,77. Начальная концентрация СCl4 равна 3,2 моль/л. Рассчитайте равновесные концентрации участников реакции.
Ответ: 2,5 моль/л; 1,4 моль/л.
159. Константа равновесия реакции PCl5 ↔ PCl3 + Cl2 равна 0,63 при 500оС. Равновесные концентрации PCl3 и Cl2 одинаковы и равны 0,54 моль/л. Найдите равновесную и исходную концентрации PCl5.
Ответ: 0,46 моль/л; 1,0 моль/л.
160. Константа равновесия системы H2(г)+ I2(г)↔ 2HI(г) при некоторой температуре равна 50. Сколько молей H2 надо взять на 1 моль I2 , чтобы 90% последнего перевести
в HI?
Ответ: 1,55 моль.
СВОЙСТВА РАСТВОРОВ
Примеры решения задач
Пример 1. Для определения относительной молекулярной массы вещества, являющегося неэлектролитом, его навеска массой 1,764 г была растворена в воде и объем раствора доведен до 100 мл. Измеренное осмотическое давление раствора оказалось равным 2,38∙10 Па при 20оС. Рассчитайте молярную массу указанного вещества.
Решение.В растворе объемом 1 м3 масса вещества составляет 17640 г. Из уравнения Вант-Гоффа, подставляя в это выражение экспериментальные данные, получим:

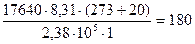 г/моль
г/моль
Пример 2. Навеска вещества массой 12,42 г растворена в воде объемом 500 мл. Давление пара полученного раствора при 25 0С равно 3297,8 Па. Как по этим данным найти молярную массу растворенного вещества?
Решение.Для определения молярной массы растворенного вещества М1 надо вычислить количество молей растворенного вещества ν1, пользуясь законом Рауля:
 ,
,
где : р - давление пара над раствором;
р0 – давление пара над чистой водой, его значение при 250С согласно табл 14
равно 3306 Па;
ν2 = 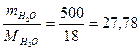 моль, после подстановки в закон Рауля получим:
моль, после подстановки в закон Рауля получим:
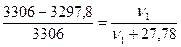 ; отсюда ν1 = ν(вещества) = 0,069 моль;
; отсюда ν1 = ν(вещества) = 0,069 моль;
М1 = 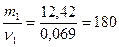 г/моль
г/моль
Пример 3. Раствор, содержащий 0,85 г хлористого цинка ZnС12 в 125 г воды, замерзает при -0,23 °С. Определите кажущуюся степень диссоциации хлористого цинка в этом растворе.
Решение.Выразим прежде всего моляльную концентрацию раствора в молях на 1000 г воды. Так как молярная масса хлористого цинка равна 136 г/моль, то
 моль/кг
моль/кг
Для растворов электролитов величина понижения точки замерзания рассчитывается по формуле
∆tзам. = i∙ К∙Ст
Криоскопическая постоянная К для воды из табл. равна 1,86 оС следовательно, изотонический коэффициент данного раствора составит:

Степень диссоциации связана с величиной изотонического коэффициента соотношением:
 или 73,5%
или 73,5%
Здесь п – количество ионов, образующихся при диссоциации молекулы ZnCl2.
Контрольные задания
161. Давление пара воды при 10° С составляет 1227,8 Па. Сколько граммов метилового спирта СН3ОН следует растворить в 388 г воды , чтобы понизить давление пара до 1200 Па?
Ответ: 16 г.
162. Раствор 1,15 г глицерина в 50 мл ацетона кипит при 56,6оС. Используя табличные данные по температуре кипения чистого ацетона и его плотности, вычислите эбуллиоскопическую константу ацетона.
Ответ: 1,56.
163. Вычислите, как различаются температуры замерзания 0,5 молярных растворов глюкозы и Na2SO4, если считать степень диссоциации соли 100%-ной.
Ответ: на 1,86 оС.
164. В каких объемных отношениях надо взять воду и этиленгликоль, чтобы приготовленный из них антифриз замерзал примерно при -20оС?
Ответ: 5 : 3.
165. Какое осмотическое давление имеет 17%-ный водный раствор сахарозы С12Н22О11 при 20оС, если плотность данного раствора составляет 1,067 г/мл?
Ответ: 1,29∙106 Па.
166. Экспериментальное значение степени диссоциации CaCl2 и AlCl3 в 0,1 m растворах приблизительно одинаково и равно 75%. Как различаются температуры кипения данных растворов?
Ответ: 100,13оС; 100,17оС
167. Раствор анилина С6Н5NH2 в диэтиловом эфире при 25оС имеет давление пара 67319 Па. Рассчитайте процентную концентрацию данного раствора.
Ответ: 7,2%.
168. Из скольких атомов состоит молекула йода в спиртовом растворе, если раствор 6,35 г иода в100 г этанола кипит при 78,59оС?
Ответ: 2.
169. Давление пара раствора 58 г K2SO4 в 300 г воды при 100оС равно 0,9560∙105 Па. Давление пара чистой воды при 100оС равно 1,0133∙105 Па. Чему равна степень диссоциации данной соли?
Ответ: 95%.
170. Раствор, содержащий неэлектролит массой 55,4 г в 2,5 л воды, кипит при 100,16оС. Чему равна молярная масса данного неэлектролита?
Ответ: 72 г/моль.
171. Чему равна температура замерзания 0,1М раствора ZnSO4 , если его степень диссоциации равна 40%?
Ответ: - 0,260С.
172. В каком количестве воды надо растворить 6,84 г глюкозы С6Н12О6, чтобы давление пара воды, равное при 65оС 250 гПа, снизилось до 248 гПа?
Ответ: 84,8 г.
173. Найдите относительную молярную массу неэлектролита, если его 10%-ный раствор замерзает при -1,15оС.
Ответ: 180 г/моль.
174. Какое осмотическое давление будет иметь при 29оС 4%-ный водный раствор FeCl3, если экспериментально найденная степень диссоциации данной соли равна 58%?
Ответ: 1,72∙106 Па.
175.Температура кипения раствора , полученного растворением 3,21 г NH4Cl в 600 мл воды, равна 100,09оС. Найдите величину степени диссоциации данной соли.
Ответ: 73%.
176. Сколько воды надо прибавить к 5 л раствора сахара, чтобы понизить его осмотическое давление в 4 раза?
Ответ: 15 л.
177.Вычислите давление насыщенного пара 1М раствора нитрата калия, имеющего степень диссоциации 61,8% и плотность 1,05 г/мл.
Ответ: 3201 Па.
178. Растворением 39,7 г мочевины (NH2)2CO в воде было получено 3 л раствора. Какое осмотическое давление имеет данный раствор при 5оС и до какой температуры его надо нагреть, чтобы повысить осмотическое давление на 25 кПа?
Ответ: 5,1∙105 Па; 292 К.
179. Найдите молекулярную формулу серы, зная, что температура кипения чистого бензола на 0,081оС ниже температуры кипения 0,8%-ного раствора серы в бензоле.
Ответ: S8.
180. Рассчитайте при 25оС давление насыщенного пара гексана над раствором 1,6 г бутанола в 100 мл гексана.
Ответ: 19571 Па.
ИОННЫЕ РЕАКЦИИ ОБМЕНА
Примеры решения задач
Пример 1. ПР(РbSО4) = 2,2.10-8. Чему равна концентрация ионов Рb2+ и SО42- в насыщенном растворе сульфата свинца и его растворимость, выраженная молярной и массовой концентрациями?
Решение.
В насыщенном растворе сульфата свинца существует гетерогенное равновесие:
РbSО4 (т)↔ Рb2+(р-р) + SО42-(р-р)
х х х
ПР(РbSО4)= 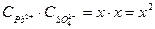
Растворимость бинарного электролита равна молярной концентрации каждого из его ионов: s=х =  =
=  1,5 10-4 моль/л. Растворимость соли, выраженная массовой концентрацией, равна s∙М= 1,5 ·10-4 моль/л ·303 г/моль = 0,0455 г/л.
1,5 10-4 моль/л. Растворимость соли, выраженная массовой концентрацией, равна s∙М= 1,5 ·10-4 моль/л ·303 г/моль = 0,0455 г/л.
Пример 2. Составьте уравнения реакций, протекающих в водных растворах, в молекулярной, ионной и сокращенной ионной формах: 1) между сульфидом натрия и сульфатом меди (II), 2) между гидроксидом железа (III) и соляной кислотой.
Решение.
Решение задачи разобьем на этапы:
а) составляем уравнение реакции в молекулярной форме:
Na2S + CuSO4 = CuS↓ + Na2SO4
б) составляем уравнение реакции в ионной форме, изобразив формулы растворимых сильных электролитов в виде ионов, на которые они диссоциируют практически полностью, а формулы остальных веществ (например, выпадающих в осадок или слабых электролитов) оставим без изменения:
2 Na+ +S2- + Cu2+ + SO42- = CuS↓ + 2Na+ + SO42-
в) исключаем из правой и левой частей одинаковые количества одноименных ионов (они подчеркнуты);
г) записываем уравнение в сокращенной ионной форме:
S2- + Cu2+ = CuS↓
2. а) составляем уравнение реакции в молекулярной форме:
Fe(OH)3 + 3 HCl = FeCl3 + 3H2O
б) составляем уравнение реакции в ионной форме, оставляя в виде молекул труднорастворимый гидроксид железа и воду, являющуюся слабым электролитом:
Fe(OH)3 ↓ + 3 H+ + 3 Cl- = Fe3+ + 3 Cl- + 3H2O
в) исключаем из правой и левой частей одинаковые количества одноименных ионов (они подчеркнуты);
г) записываем уравнение в сокращенной ионной форме:
Fe(OH)3 ↓ + 3 H+ + = Fe3+ + 3H2O
Пример 3. Вычислите концентрацию ионов СН3СОО- в растворе, 1 л которого содержит 0,1 моль СН3СООН и 0,2 моль НCl, считая диссоциацию HCl полной.
Решение.
1. Напишем уравнение диссоциации уксусной кислоты:
СН3СООН↔СН3СОО- + Н+
2. Напишем выражение константы диссоциации уксусной кислоты:
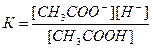
3. Соляная кислота является сильной и диссоциирует полностью, поэтому [H+]=0,2
HCl↔H+ + Cl-
4. Подставим все значения в выражение константы диссоциации уксусной кислоты:


[CH3COO-] = 9.10-6
Пример 4.Вычислите рН 1%-ного раствора уксусной кислоты. Плотность раствора принять равной 1.
Решение.
Вычислим молярную концентрацию уксусной кислоты, учитывая, что плотность раствора равна 1, тогда объем раствора равен массе и равен 100 мл:

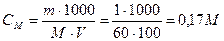
Напишем уравнение диссоциации уксусной кислоты:
х х
СН3СООН↔СН3СОО- + Н+
1 моль 1 моль
Напишем выражение константы диссоциации уксусной кислоты:
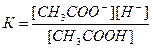
Подставим все значения в выражение константы диссоциации уксусной кислоты:
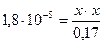
х = [H+] = 1,7.10-3
Вычислим значение рН:
рН = -lg[H+] = - lg 1,7.10-3= - (lg1,7 + lg10-3) = 2,8
Контрольные задания
181. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) CdCl2 и K2S;
б) КНSiО3 и НСl.
Чему равна концентрация каждого иона в насыщенном растворе Ag3PO4? Произведение растворимости (ПР) равно 1,3×10-20.
Ответ: 2,63.10-4;7.9.10-4
182. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Cu2+ + CO32- = CuCO3↓;
б) 2Н+ + 2NO2- = NO↑ + NO2↑ + H2O.
Исходя из значения произведения растворимости PbСО3, вычислите массу соли, содержащуюся в 100 мл насыщенного раствора. Произведение растворимости равно
7,5×10-14.
Ответ: 0,0072 мг
183. Какое из веществ (KHCO3, CdSO4 или K3PO4) будет взаимодействовать с KOH? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
В растворе HIO концентрации 0,1 М степень диссоциации равна 0,05%. При какой концентрации раствора степень диссоциации увеличится в два раза?
Ответ: 0.025 М
184. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) KHCO3 и H2SO4;
б) MgSO4 и Na3PO4.
Рассчитать концентрацию ионов СlО- в растворе, 1 л которого содержит 0,1 моля хлорноватистой кислоты НСlО и 0,02 моля соляной кислоты HCl, если последняя диссоциирует полностью.
Ответ: 1,5.10-7
185. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) 3Bа2+ + 2РО43- = Bа3(РО4)2↓;
б) NH4+ + OH- = NH4OH.
Чему равна растворимость MnS в моль/л и г/моль? Произведение растворимости равно 2,5×10-10.
Ответ: 1,58.10-5 моль/л;1,37.10-3 г/л
186. Какое из веществ: Zn(ОН)2, CuSO4 или K2CrO4 будет взаимодействовать с КОН? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
В насыщенном растворе фторида стронция концентрация ионов F- равна 1,1×10-3 моль/л. Вычислите концентрацию ионов Sr2+ в этом растворе. Произведение растворимости равно 2,5×10-9.
Ответ: 2,1.10-3 моль/л
187. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) K3BO3 и HNO3;
б) K3PO4 и CaCl2.
Сколько граммов NaОН находится в состоянии полной диссоциации в 5 л раствора, рН которого равен 12?
Ответ: 2 г
188. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) SO32- + 2H+ = H2O + SO2↑;
б) Hg2+ + 4Br- = [HgBr4]2-.
Вычислите рН 0,1 М раствора NH4OH.
Ответ: 11,12
189. Какое из веществ: KHCO3, Cu(NO3)2 или Ca(OH)2 будет взаимодействовать с HCl? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
Вычислите степень диссоциации синильной кислоты HCN, если в 200 мл раствора ее содержится 5,4 г синильной кислоты.
Ответ: 2,24.10-5
190. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) AgNO3 и ВаСl2;
б) MnCl2 и NH4OH.
Вычислите концентрации всех ионов в 0,1 м. растворе NaCl, K2SO4, Na3PO4, если степень диссоциации равна 90%.
Ответ: 0,09 М; 0,18 М, 0,09 М; 0,27 М, 0,09 М
191. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Cd2+ + 4NH4OH = [Cd(NH3)4]2+ + 4 H2O;
б) СО32- + 2H+ = CO2↑ + H2O.
Растворимость BaCrO4 равна 2,35 мг на 1 л. Вычислите ПР этой соли.
Ответ: 10-10
