Классификация реакций, применяющихся в кинетике
Гомогенная реакция происходит в гомогенной системе и осуществляется во всем объеме этой системы.
Гетерогенная реакция происходит между веществами, образующими гетерогенную систему. Она проходит только на поверхности раздела фаз этой системы. Например:
Fe + 2НСl→FeCl2 + Н2
Растворение металла в кислоте может происходить только на поверхности металла, так как только здесь контактируют друг с другом оба реагирующих вещества.
Микрогетерогенный катализ - это такой тип катализа, когда катализатор и реагенты находятся в коллоидно-дисперсном состоянии. Размеры частичек ферментов близки к размерам мицелл коллоидных растворов – 1-100 нм. По отношению к субстратам, частички которых часто намного меньше, катализаторы являются гетерогенными.
Различают простые и сложные реакции. Простыми, элементарными являются одностадийные реакции. Например:
Н2 + I2 → 2HI, СH3-N=N-CH3 → C2H6 + N2
Простых реакций мало, большинство процессов - сложные. Сложныминазываются многостадийные реакции.
Сложные, или многостадийные, реакции могут быть параллельными, последовательными, сопряженными, цепными, фотохимическими и т. д.
Параллельные - это реакции, в результате которых из одного или нескольких веществ в зависимости от условий образуются различные продукты, например, при термическом разложении хлората калия одновременно идут два превращения:
 KCl + O2
KCl + O2
 KClO3
KClO3
 KClO4 + KCl
KClO4 + KCl
В организме параллельно с биологическим окислением глюкозы может происходить ее молочнокислое или спиртовое брожение. В биосистемах таких случаев много. Организм должен найти оптимальные доли каждого из направлений.
Последовательные (консекутивные)- это реакции, которые протекают в несколько стадий. Продукты, образовавшиеся в первой стадии, являются исходными веществами для второй и т. д.:
k1 k2 k3
A → B → C → D
Примерами последовательных реакций в организме могут быть биологическое окисление глюкозы, гидролиз АТФ и др. Скорость процесса определяется скоростью самой медленной стадии, которую называют лимитирующей.
Сопряженные - это частный случай параллельных реакций:
A + B → E;
A + C → F;
из которых первая протекает лишь совместно со второй, т.е. индуцируется второй реакцией. Первая реакция не происходит до тех пор, пока не введено в систему вещество С - индуктор. Явление химической индукции впервые исследовал в 1905 г. русский ученый А.Н. Шилов.
В биологических системах все эндергонические реакции протекают по механизму сопряженных реакций. Клеточное окисление углеводов или липидов в организме приводит к синтезу аденозинфосфорной кислоты, которая, в свою очередь, индуцирует другие превращения, в частности биосинтез белков и нуклеиновых кислот.
Цепные - это реакции, происходящие с участием свободных радикалов (остатков молекул, имеющих неспаренные электроны и проявляющих вследствие этого очень высокую реакционную способность).
Примером цепной реакции может быть синтез хлороводорода:
H2+Cl2 → 2HCl.
Под действием кванта энергии молекула Сl2 образует два радикала.
Реакция начинается при облучении смеси исходных веществ ультрафиолетовым светом:
hv
 С12 Cl· + Cl· (зарождение цепи).
С12 Cl· + Cl· (зарождение цепи).
Далее происходит развитие цепи:
Cl· + Н2 → НСl+ Н·;
Н· + Сl2 → НСl + Cl·.
Это пример неразветвленной цепной реакции.
В разветвленной цепной реакции взаимодействие свободного радикала с молекулой исходного вещества вызывает образование не одного, а двух или большего числа новых радикалов:
2Н2 + О2 → 2Н2О;
Н2 + О2 → ОН· + ОН·;
ОН· + Н2 → Н2О + H·;
H· + О2 → ОН· + O·;
O· + Н2 → ОН· + H·.
Обрыв цепи может происходить при рекомбинации свободных радикалов, а также при взаимодействии их с посторонними веществами.
Токсические вещества часто действуют по цепному механизму, обусловливая в организме необратимые изменения. Вещества, способные обрывать разветвленное цепное окисление и таким образом предотвращать окислительные процессы, называются антиоксидантами.
Примером антиоксиданта, препятствующего в организме окислению ненасыщенных липидов и предохраняющего биологические мембраны от разрушения, является витамин Е. Его биологическая активность основана на способности образовывать устойчивые свободные радикалы в результате отщепления атома водорода от гидроксильной группы. Эти радикалы вступают во взаимодействие с другими свободными радикалами, которые способствуют образованию органических пероксидов.
Цепные реакции играют важную роль в ряде патологических биопроцессов: канцерогенез, лучевая болезнь и др. К цепным процессам принадлежат ядерные реакции, взрывы, реакции полимеризации и др.
Зависимость скорости реакции от концентрации. Молекулярность элементарного акта реакции. Порядок реакции. Кинетические уравнения реакций первого и нулевого порядков. Период полупревращения
Молекулярность реакции определяется числом частиц, принимающих участие в элементарном акте столкновения. Реакции бывают мономолекулярными, би- и тримолекулярными. Вероятность столкновения трех частиц одновременно очень мала, четырехмолекулярные реакции неизвестны.
Примером мономолекулярной реакции является:
СH3-N=N-CH3 → C2H6 + N2;
бимолекулярной: H2 + I2 → 2HI.
Общий порядок реакции определяется как сумма показателей степеней концентраций в кинетическом уравнении реакции:
V = k[A]a[B]b.
Порядок реакции находят экспериментальным путем. Он может быть нулевым, целочисленным или дробным.
Если одно из реагирующих веществ находится в большом избытке, т.е. его концентрация практически не меняется, то порядок реакции по этому веществу равен нулю (нулевой порядок, V = kс0 = k). Примером такой реакции является инверсия водного раствора сахарозы:
С12Н22О11 + Н2О ↔ С6Н12О6 + С6Н12О6,
глюкоза фруктоза
в которой концентрация Н2О очень высока и в процессе реакции практически не изменяется, [Н2О] = const. Порядок реакции по воде является нулевым (n=0), а по сахарозе, как установлено экспериментально, первым. Общий порядок реакции равен n + m = 0 + 1 = 1 (V = kc).
Кинетическое уравнение имеет вид:
V = k [С12Н22О11].
Примером реакции второго порядка (V = kc2) является
H2 + I2 → 2HI;
V = k [H2][ I2];
n + m = 1 + 1 = 2.
Примерами биохимических реакций нулевого порядка служат ферментативные процессы, при которых субстрат находится в избытке, а количество фермента ограниченно. Реакциями первого порядка среди биохимических являются конечные стадии ферментативных процессов, реакции антигенов с антителами, изомерного превращения, гидролиза и т.д. Реакции, имеющие порядок больше чем два, среди биохимических процессов не встречаются.
Порядок реакции (экспериментальная величина) определяет зависимость скорости реакции от концентрации реагирующих веществ, а молекулярность (теоретическая величина) дает молекулярно-кинетическую характеристику процесса.
Численно для простых (элементарных) реакций молекулярность и порядок совпадают.
В кинетике часто пользуются понятием период полупревращения τ1/2.
Периодом полупревращения называют время, необходимое для того, чтобы прореагировала половина исходного количества вещества.
Период полупревращения используют также для характеристики процессов радиоактивного распада. И хотя эти процессы не являются химическими (их скорость не зависит от температуры), кинетически они описываются уравнением реакции первого порядка.
Характерной особенностью ферментативного катализа является возрастание скорости реакции до определенной постоянной величины (Vmax). Типичная кривая зависимости скорости ферментативной реакции и от концентрации субстрата [S] приведена на рис. 2.2.
В 1913 г. Михаэлис и Ментен предложили теорию, объясняющую эту зависимость. Для ферментативного процесса:
k1 k3

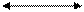 E + S ES E+P,
E + S ES E+P,
k2
где Е - фермент; S - субстрат; ES - промежуточный фермент-субстратный комплекс; Р - продукт реакции; k1, k2, k3 - константы скоростей соответствующих реакций.
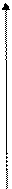 |

 Vmax
Vmax
 Vmax/2
Vmax/2

Km [S]
Рис. 2.2. Зависимость скорости ферментативной реакции от концентрации субстрата
Km = (k2 + k3)/ k1 - константа Михаэлиса.
На практике пользуются Vmax, т.е. скоростью, с которой реагирует фермент, полностью находящийся в виде комплекса ES.
Если V0 = Vmax/2, то Km = [S]
т.е.: значение константы Михаэлиса численно равно концентрации субстрата, при которой скорость реакции составляет половину максимальной.
Кинетическая константа k3 в уравнении Vmax = k3[E0] называется числом оборотов фермента; она показывает число молекул субстрата, которое превращается в продукт реакции в условиях, когда весь фермент находится в составе фермент-субстратного комплекса.
Величина константы Михаэлиса зависит от значения рН, температуры, природы субстрата и т.д. Ее значения, которые приводятся наряду с Vmax и числом оборотов фермента, являются количественные параметром ферментативной реакции при определенных условиях.
Уравнение Михаэлиса-Ментен:
V = Vmax×[S]/(Km+[S])
Закономерности химической кинетики используют в фармакокинетике и токсикокинетике, изучающих скорости действия и выведения из организма соответственно лекарственных средств и ядов.
Обычный путь действия лекарственного средства в организме можно рассматривать как последовательность двух процессов: всасывания из желудка в кровь (характеризуется константой всасывания kв) и выведения (элиминации) из крови в мочу (характеризуется константой выведения kэ).
Кинетика изменения массы лекарственного средства в желудке mж, в крови mк и в моче mм описывается системой трех дифференциальных уравнений, решаемой графически; на основании этого прогнозируют лечебную дозу лекарства m0 и время принятия очередной дозы.
