Методика решения типовых задач по темам курса
Тема 1 Химическая термодинамика
Задание: Провести термодинамический расчет химической реакции
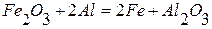
в интервале температур от 298 до 1100 К.
Таблица 1 – Исходные термодинамические величины
| Вещество | 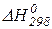 , кДж/моль , кДж/моль | 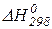 , Дж/моль·К , Дж/моль·К | Коэффициенты уравнения 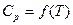 | Тф.п., К | 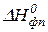 , кДж/моль , кДж/моль | ||
| α | β∙10 | γ∙105 | |||||
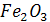 | -821.32 | 89,96 | 97,74 | 72,13 | -12,89 | - | |
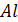 | 28,31 | 20,67 | 12,39 | - | 931,5 | ||
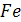 | 27,15 | 19,25 | 21,0 | - | - | ||
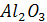 | -1675 | 50,94 | 114,56 | 12,89 | -34,31 | - |
Решение:
Расчет теплового эффекта при стандартных условиях
По закону Гесса тепловой эффект реакции равен разности между суммой стандартных теплот образования продуктов реакции и суммой стандартных теплот образования исходных веществ с учетом стехиометрических коэффициентов.
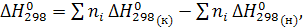 (1)
(1)
где 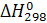 – тепловой эффект химической реакции при стандартных условиях;
– тепловой эффект химической реакции при стандартных условиях;
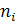 – стехиометрические коэффициенты.
– стехиометрические коэффициенты.
Подставляя числовые значения, получим:
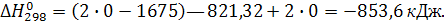
Расчет теплового эффекта по уравнению Кирхгофа
Расчет теплового эффекта химической реакции проводится с помощью уравнения Кирхгофа:
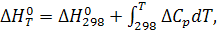 (2)
(2)
где 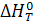 – тепловой эффект химической реакции при температуре Т;
– тепловой эффект химической реакции при температуре Т;
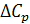 – разность теплоемкостей продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
– разность теплоемкостей продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
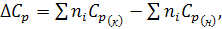 (3)
(3)
Для расчетов необходимо знать зависимость теплоемкости от температуры для исходных веществ и продуктов реакции, выражаемую уравнением:
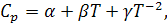 (4)
(4)
где α, β, γ коэффициенты, которые определяются опытным путем и приведены в справочнике [1].
Подставляем в уравнение (4) значения из таблицы 1:
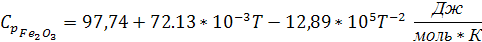
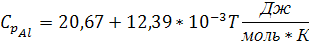
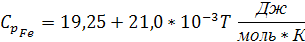
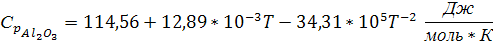
Так как температура плавления алюминия входит в заданный интервал температур, тогда при температуре 931,5 К будет происходить фазовый переход алюминия из твердого состояния в жидкое. Удельная теплоемкость для алюминия в жидком состоянии:
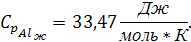
Из уравнений (3), (4) следует:
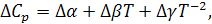 (5)
(5)
где 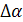 ,
, 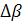 ,
, 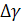 – разность коэффициентов α, β, γ продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
– разность коэффициентов α, β, γ продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
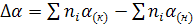 , (6)
, (6)
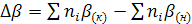 , (7)
, (7)
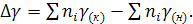 (8)
(8)
Для процесса, проходящего при температуре не превышающую температуру плавления алюминия, получим разность коэффициентов α, β, γ:
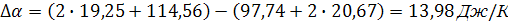
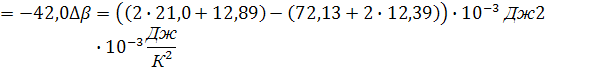
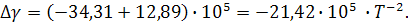
Согласно выражению (5), уравнение зависимости теплоемкости от интеграла температуры до фазового перехода выглядит следующим образом:
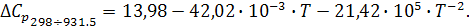
Аналогично производим вычисления зависимости теплоемкости от интеграла температуры после фазового перехода, учитывая величину 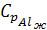 :
:
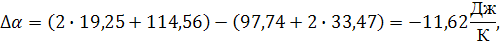
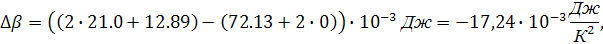
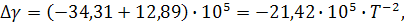
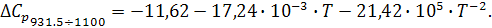
В связи с тем, что имеется фазовый переход, уравнение теплового эффекта химической реакции будет иметь вид:
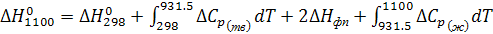 (9)
(9)
Проинтегрировав уравнение (9) получим:
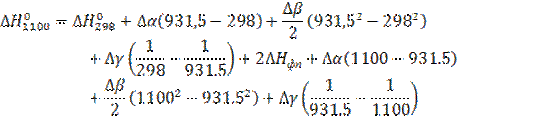 , (10)
, (10)
где 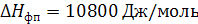
Подставляя числовые значения получим:
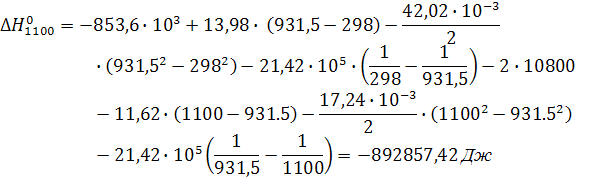
Значение теплового эффекта химической реакции 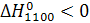 . Это означает, что в ходе реакции выделяется тепло. Процесс является экзотермическим.
. Это означает, что в ходе реакции выделяется тепло. Процесс является экзотермическим.
