Якісні реакції органічних речовин
Реактиви й матеріали: цукор; крохмаль;сечовина; сульфанілова кислота; нітропрусид натрію; ацетат натрію; оцтова кислота; етиловий спирт; тетрахлорметан; фільтрувальний папір; мідна спіраль із тонкого дроту.
Дослід І. ВИЯВЛЕННЯ КАРБОНУ Й ГІДРОГЕНУ
Для виявлення Карбону й Гідрогену досліджувану органічну речовину нагрівають у пробірці з сухим оксидом купруму. При цьому з Карбону органічної речовини й Оксигену оксиду купруму утворюється вуглекислий газ, а з Гідрогену органічної речовини й Оксигену оксиду купруму - вода. Оксид купруму при цьому відновлюється до металічного Купруму.
Порядок виконання роботи
У суху пробірку вносять добре перемішану суміш приблизно 2 г сухого порошкоподібного оксиду купруму і 0,2 г розтертої органічної речовини (цукор, крохмаль, бензенова кислота, нафтален, сечовина тощо). Пробірку закріплюють у затискачі штатива майже в горизонтальному положенні так, щоб верхній її кінець із пробкою був трохи вище нижнього. У верхню частину пробірки кладуть шматочок свіжо прожареного (безбарвного) сульфату купруму і щільно закривають пробкою з газовідвідною трубкою. Кінець газовідвідної трубки вставляють в другу пробірку, куди попередньо наливають 4–5 мл вапняної або баритової води.
Спочатку всю пробірку із сумішшю обережно нагрівають па невеликому полум'ї пальника, а потім сильно нагрівають її нижню частину із досліджуваною речовиною. Під час нагрівання органічна речовина розкладається. Карбон з'єднується з Оксигеном оксиду купруму й утворює вуглекислий газ, а Гідроген — воду:
C12H22O11 + 24CuO → 12СО2 + 11H2O + 24Cu.
цукроза
Утворення крапель води на стінках пробірки або газовідвідної трубки, а також посиніння сульфату купруму свідчить про наявність в органічній сполуці Гідрогену: CuSO4 + 5H2O → CuSO4 • 5H2O.
Безбарвна
речовина
кристалогідрат синього кольору
Помутніння вапняної або баритової води від вуглекислого газу означає наявність Карбону в органічній речовині: Ca(OH)2 + CO2 → CaCO3 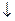 + H2O.
+ H2O.
Дослід 2. ВИЯВЛЕННЯ НІТРОГЕНУ
ЗА РЕАКЦІЄЮ ЛАССЕНЯ
Увага! Дослід проводять у витяжній шафі за склом або в захисних окулярах, оскільки за умови необережного поводження з Натрієм може статися нещасний випадок.
Порядок виконання роботи
У суху пробірку вносять 0,2–0,3 г досліджуваної речовини, наприклад сечовини, білка, сульфанілової кислоти, й шматочок величиною з горошину Натрію, віджатого між аркушами, фільтрувального паперу й очищеного від оксидної плівки. Обережно нагрівають її на полум'ї пальника, тримаючи дерев'яним затискачем. При цьому відбувається спалах та обвуглювання речовини. Пробірку прожарюють до червоного кольору. Досліджувана речовина розкладається, і Нітроген з'єднується з Карбоном, утворюючи ціанід натрію. Розжарений кінець пробірки занурюють у фарфорову чашку з 8 – 10 мл дистильованої води. Пробірка від швидкого охолодження розтріскується (дотримуйтеся обережності!), руйнується і її вміст розчиняється у воді. (Цю операцію слід проводити на віддалі від інших дослідників, не нахиляючись над чашкою, оскільки залишки Натрію в пробірці бурхливо реагують із водою). Розчин відфільтровують від шматочків вугілля та скла. До фільтрату послідовно додають 2 – 3 мл свіжо приготовленого концентрованого розчину сульфату форуму (II), кілька крапель розчину хлориду феруму (III) і підкислюють 1 %-ним розчином соляної кислоти до слабокислої реакції. Синій осад утвореної берлінської лазурі свідчить про наявність Нітрогену в дослідженій речовині.
Реакція проходить за таким рівнянням:
C + N + Na → NaCN;
2NaCN + FeSO4 → Fe(CN)2 + Na2 SO4;
4NaCN + Fe(CN)2 → Na4[Fe(CN)6];
3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3+ 12NaCl.
