Класифікація реакцій за способом розриву зв’язків
Можливі два головних типи розриву ковалентних зв'язків: гомолітичний і гетеролітичний.
Гомолітичний розрив (гомоліз). При гомолітичному розриві зв'язку С–Х у молекулах R3C–X відбувається “симетричне” роз'єднання пари електронів ковалентного зв'язку так, що один електрон залишається біля атома Карбону, а другий переходить до частинки X:
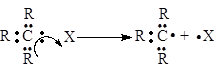
Тобто у кожного з початково сполучених атомів залишається по одному електрону (позначається крапочкою біля відповідної частинки). Частинки або атоми (X може бути атом), які утворилися при цьому і мають по одному неспареному електрону, називають вільними радикалами. Отже, радикал – це частина молекули, яка має неспарений електрон, але не має заряду, наприклад, радикал метил Н3С×. Радикали дуже не стійкі, вони миттєво вступають у подальші перетворення, вступаючи в реакції радикального заміщення (SR) і реакції приєднання (AR).
Гомолітичні радикальні реакції характерні для молекул, які побудовані з атомів, що мають близькі або однакові електронегативності. Умовою перебігу таких реакцій є висока температура або УФ, γ опромінення, наявність пероксидів або неполярних розчинників.
Гетеролітичний розрив хімічних зв'язків (гетероліз). Гетеролітичний, або іонний, розрив s-зв’язку відбувається “несиметрично”. При цьому в молекулі R3С–Х розрив s-зв’язку С–Х може відбуватися з переходом пари електронів до атома Карбону або до частинки X. Якщо пара електронів перейшла до X, то утворюється карбкатіон R3C+, а якщо до Карбонового атома, то утворюється карбаніон R3C-:
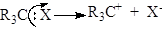 ;
;
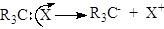 .
.
Гетеролітичні (йонні) реакції можуть бути електрофільними, позначаються індексом Е (від лат. electrophilic – той, що полюбляє електрон) або нуклеофільними, позначають індексом N (від лат. Nucleophilic – той, що полюбляє ядро), залежно від діючого агента. Карбкатіони є найсильнішими електрофілами. Електрофіли або електрофільні реагенти – це частинки, які мають повний або частковий позитивний заряд (вакантну зв'язуючу орбіталь або дефіцит електронів) і тому є акцепторами електронів. Молекули електрофільних реагентів у процесі реакції можуть також генерувати електрофільні частинки. До електрофільних реагентів крім карбкатіонів R3С+ відносять катіони Н+, Сl+, Вг+, J+, NO2+ та ін. Електрофіли вступають у реакції заміщення і приєднання (SE- і АR-реакції). Наприклад:
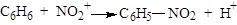 ;
;
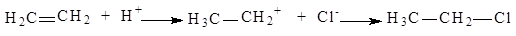
Нуклеофіли або нуклеофільні реагенти, – аніони або молекули з вільними парами електронів, які мають спорідненість до електрофілів або до позитивно зарядженого центра субстрату і намагаються з ним сполучитися. Нуклеофільними реагентами є карбаніони R3С- найчастіше трапляються аніони Н3СО-, С2H5О-, С6Н5О-, НО-, СN-, NН2-, Н3ССОО-, І-, СІ-, F- та ін., нейтральні молекули з вільними парами електронів.
Нуклеофіли найчастіше вступають у реакції заміщення (SN-реакції). Наприклад:
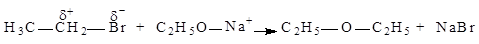 .
.
В залежності від діючих реагентів реакції поділяють:
| Реагент | Назва реакції |
| +Н2 | гідрування |
| - Н2 | дегідрування |
| + Н2О | гідратація |
| - Н2О | дегідратація |
| + СО2 | карбоксилювання |
| - СО2 | декарбоксилювання |
| + NH3 | амінування |
| - NH3 | дезамінування |
| + Hal | галогенування |
| + NO2 | нітрування |
