Находим стандартную энергию Гиббса
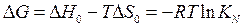 .
.
∆G0 = -20000 + 15,44 Т;
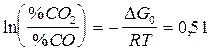 .
.
%СО2 / %СО = 1,73 или 36%СО и 64% СО2 .
Однако, если реагирующие вещества находятся в растворе, то на равновесие обратимых реакций будут сильно влиять активные концентрации в растворе.
Термодинамика растворов
Растворами называются гомогенные многокомпонентные смеси переменного состава. В растворах частицы веществ равномерно распределены по объему и их концентрация может плавно изменяться в достаточно широких пределах. Последнее свойство отличает растворы от химических соединений, характеризуемых определенным количественным соотношением между входящими в их состав атомами.
Различают конденсированные ( твердые или жидкие ) и газовые ( газовые смеси ) растворы. Вещество, концентрация которого превышает 50%, являются растворителем, остальные компоненты – растворенными веществами.
Вещества имеют ограниченную растворимость, если после достижения определенной концентрации в равновесии с раствором находится свободное растворяемое вещество. Раствор, находящийся в термодинамическом равновесии – с нерастворенным остатком, называется насыщенным. Насыщение может также наступать в результате образования химических веществ между растворителем и растворяемыми веществами. Растворимость зависит от природы растворителя, содержания других компонентов, температуры и давления. Если исходные вещества раствора конденсированные, то влиянием давления пренебрегают.
Процесс растворения сопровождается двумя явлениями.
1. Рассеивание частиц по объему смеси – физическая сторона процесса.
2. Разрушение старых и образование новых связей между частицами однородных веществ в растворе – химическая сторона процесса.
Физическая сторона растворения изучает закономерность образования идеального раствора, когда характер связей между частицами в исходном и растворенном состояниях тождественен. Если связи различаются, то растворение сопровождается явлениями, характерными для химических реакций: тепловой эффект, изменение объема.
Современные теории растворов базируются на физической теории и учете химических явлений при растворении путем введения соответствующих поправок.
В сварочных процессах участвуют газовые смеси, металлические растворы и шлаки.
Газовые смеси в условиях сварочных температур являются идеальными растворами. Компоненты сохраняют свою химическую индивидуальность, а состав смеси поддается точному расчету методами химической термодинамики.
Металлические растворы разделяются на растворы внедрения и замещения.
Растворы внедрения образуются при растворении неметаллов О, Н, N, Р, С, S, В.
Растворы замещения образуются в сплавах и металлов, близких по параметрам кристаллической решетки и атомным радиусам.
Растворимость веществ при переходе из твердого состояния в жидкое резко возрастает. Однако жидкие и, тем более, твердые растворы существенно отличаются от идеальных. Различие ослабевает с ростом температуры.
Шлаки представляют собой сплавы окислов и солей металлов. Они образуются при сварке и пайке при плавлении флюсов и электродных покрытий.
В зависимости от характера изменения термодинамических свойств веществ при образовании раствора, различают следующие классы растворов:
1.Совершенный ( близкий к идеальному ) раствор. Энтальпия растворения Нр = 0. Приращения энтропия ∆Si = – R ln аi , где аi – активность i-ого компонента. Активность можно рассматривать, как исправленную мольную долю, при подстановке которой в уравнение идеальных растворов вместо Ni получается результаты, согласующиеся с опытом.
аi = γi Ni
где γi – коэффициент активности, для совершенных растворов близок к 1, в особенности при высоких температурах.
Совершенными растворами являются растворенные в железе Со, Cr, Mn, Mo, W.
2.Неидеальный сильноразбавленный конденсированный раствор. В области малых концентраций γi ≠ 1, активность пропорциональна мольной доле. Коэффициент активности растворителя практически равен 1. Пример – растворы в железе меди и кремния.
3.Компонент с ограниченной растворимостью. При превышении концентрации выше критической в системе появляются чистый компонент, следовательно его активность
аi нас = 1.
С другой стороны
аi нас = γi насNi нас
Коэффициент активности γi = 1/ Ni нас
Для ненасыщенного раствора аi = Ni / Ni нас
4.Регулярный раствор характеризуется тем, что приращение энтропии компонента i подчиняется закону идеальных растворов, но растворение сопровождается тепловым эффектом. Если допустить, что тепловой эффект слабо зависит от температуры, то
∆Hi = RT ln γi
Пример регулярных растворов – растворенные в железе Ni, Al, V.
