Изотерма химических реакций
Рассмотрим при T = const, р = const реакцию А+В↔АВ, причем вещества взяты в концентрациях NA, NВ и NAВ.
Т.к. концентрации неравновесные, то введем обозначение
П= NAВ /NA · NВ.
Тогда ΔG = ΔН – TΔS+ RT ln П.
Для этой же реакции в условиях равновесия
ΔG = ΔН – TΔS+ RT ln KN.
Вычитая первое уравнение из второго, получим
ΔG = RT( ln П – ln KN).
Это уравнение называется изотермой химической реакции и позволяет предсказать направление реакции.
Если δG < 0, то реакция идет вправо;
δG > 0, то реакция идет влево.
В частном случае
NAB→0; П→ ∞; ln П → – ∞.
Реакция пойдет в сторону образования АВ.
Равновесие в гетерогенных системах. Правило фаз
Гетерогенной называется система, состоящая из отдельных частей, ограниченных физическими поверхностями раздела (фаз). Гетерогенные системы могут быть построены из нескольких веществ (многокомпонентные) и из одного вещества – многокомпонентные.
Число компонентов К равно разности между числом веществ в системе и количеством независимых реакций между ними. Рассмотрим пример.
 |
|
|
|
 СаСО3 ↔ СаО + СО2
СаСО3 ↔ СаО + СО2 Достаточно знать только два вещества, а третье получится из уравнения реакции : К=3-1=2.
Число компонентов–количество различных видов молекул, необходимых для построения данной системы.
Общее условие равновесия гетерогенных систем – равновесие между отдельными частями системы (фазами).
Параметры гетерогенной системы: температура Т, давление р и концентрация всех компонентов во всех фазах, если они имеют сложный состав.
Условие равновесия прежнее:
ΔG → 0; G → min.
Однако условие равновесия зависит также и от строения системы (числа фаз Ф и числа компонентов К), при этом устанавливаются связи между параметрами равновесия, причем некоторые параметры остаются свободными, т.е. могут изменяться без изменения строения системы (числа фаз). Это соотношение отражает правило фаз Гиббса – Коновалова:
С=К-Ф+2, где С – число степеней свободы.
Пример 1: СаСО3 ↔ СаО + СО2 .Здесь К=2, Ф=3, С=1.
Система моновариантная – давление является функцией температуры
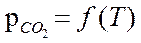
Пример 2. FeOтв + СО ↔ Feтв + СО2
Число фаз – 3, число компонентов – 3, С=2.
Система бивариантная, параметры равновесия – Т, р и х.
pСО = f(T,x) .
Пример 3. Нонвариантная система «лед + вода + пар»
Тройная точка воды.
Константа равновесия в гетерогенных системах
Равновесие в гетерогенных системах определяется из условия
T = const, p = const, ∆G → 0, G → min.
Рассмотрим реакцию
FeOтв + СО ↔ Feтв + СО2 .
Параметры равновесия – Т, рСО, 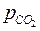 .
.
Константа равновесия
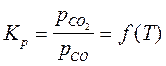 .
.
Т.к. число молей газовой смеси неизменно, то
Кр =КN .
