Общие понятия. Классификация
Электрохимические методы анализа основаны на измерении и регистрации электрических параметров системы (аналитических сигналов), изменяющихся в результате протекания химических реакций.
Электрохимическая система обычно состоит из электрохимической ячейки, представляющей собой единое конструктивное оформление сосуда с исследуемым раствором и электродами. Принята следующая классификация этих методов:
1 Классификация, учитывающая природу источника электрической энергии в системе. Различают две группы методов:
- методы без наложения внешнего потенциала. Здесь источник электрической энергии – сама электрохимическая система (гальванический элемент). К таким методам относятся потенциометрические методы.
- методы с наложением внешнего потенциала. К ним относятся: кондуктометрия, вольтамперометрия, кулонометрия, электрогравиметрия.
2 Классификация по способу применения. Различают прямые и косвенные методы.
- прямые методы. Измеряют аналитический сигнал как функцию концентрации раствора и по показаниям прибора находят содержание вещества в растворе (Прямая потенциометрия, прямая кондуктометрия и т. д.).
- косвенные методы - это методы титрования, в которых окончание титрования фиксируют на основании измерения электрических параметров системы (кондуктометрическое, амперометрическое титрование и т. д.).
Развитию и усовершенствованию электрохимических методов анализа способствовали успехи в области электрохимии и приборостроении. Различия между электрохимическими методами анализа в основном обусловлены природой электродов и измерительными приборами.
7.3.2 КОНДУКТОМЕТРИЯ (КОНДУКТОМЕТРИЧЕСКИЙ АНАЛИЗ)
Основатель этого метода -немецкий физик Кольрауш, который впервые в 1885 г. предложил уравнение зависимости электропроводности растворов сильных электролитов от концентрации. Электропроводность растворов обусловлена диссоциацией растворенного вещества и миграции образующихся ионов под действием внешнего источника напряжения.
Движущиеся ионы в поле электрического тока испытывают тормозящее действие со стороны молекул растворителя - релаксационный эффект –и со стороны противоположно заряженных ионов - электрофоретический эффект. В результате этих торможений раствор оказывает сопротивление прохождению электрического тока. То есть электропроводность (W) . это величина обратная сопротивлению:
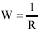 , сименс (См = Ом-1, обратный Ом).
, сименс (См = Ом-1, обратный Ом).
Зависимость электропроводности от концентрации выражается уравнением
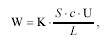
где K - коэффициент пропорциональности; S - площадь электродов;
с - концентрация ионов; U - подвижность ионов; L - расстояние между электродами.
Для данной пары электродов при L,S= constполучим:
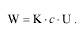
Различают удельную ( 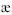 , каппа) и эквивалентную электропроводность (λ).
, каппа) и эквивалентную электропроводность (λ).
Удельная электропроводность( 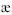 ) - это электропроводность 1 см3 раствора, находящегося между электродами площадью 1 см2 каждый, расположенными на расстоянии 1 см друг от друга. Размерность:
) - это электропроводность 1 см3 раствора, находящегося между электродами площадью 1 см2 каждый, расположенными на расстоянии 1 см друг от друга. Размерность:
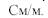
Эквивалентная электропроводность(λ) - это электропроводность 1 н раствора электролита, измеренная при расстоянии L = 1 см. Размерность: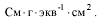
Зависимость 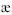 и λ выражается уравнением
и λ выражается уравнением
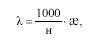
где н - нормальная концентрация.
Таким образом, в кондуктометрии аналитическим сигналом является электропроводность.
Различают: прямую кондуктометрию и кондуктометрическое титрование.
Прямая кондуктометрия
Измеряют электропроводность исследуемого раствора и по градуировочному графику, построенному в тех же условиях для стандартных растворов, определяют концентрацию исследуемого раствора.
Метод нашел ограниченное применение, так как он неселективен, т. е. электропроводность – величина аддитивная, обусловленная присутствием всех ионов. Тем не менее, метод используется для непрерывного контроля производства: качества пищевых продуктов, определения влажности различных материалов (бумаги, газов, зерна, текстильных материалов) и широко применяется для определения общего солевого состава воды (речной, минеральной, дистиллированной); для определения растворимости малорастворимых электролитов; определения констант диссоциации электролитов в том числе комплексных соединений (Кн).
Нередко его сочетают с другими методами, такими как потенциометрия, рефрактометрия, хроматография.
Однако сложности зависимости электропроводимости от концентрации существенно отражаются на этом методе. С ростом концентрации электропроводность вначале растет, а при более высоких концентрациях (> 3 н) резко уменьшается. Этот метод применим для анализа разбавленных растворов.
