Кислотно-основная классификация катионов
| № группы | I | II | III | IV | V | VI | |
| Катионы | Na+, K+, NH4+ | Ag+, Pb2+, Hg22+ | Ba2+, Ca2+, Sr2+ | Al3+, Zn2+, Cr3+, Sn2+ | Fe3+, Fe2+, Mg2+, Mn2+ | Cu2+, Co2+, Ni2+, Hg2+, Cd2+ | |
| Групповой реактив | нет | 2н HCl | 2н H2SO4 в присутствии С2Н5ОН | 2н NaOH | |||
| Характер получаемых соединений | К+, Na+, NH4OH | AgCl, PbCl2, Hg2Cl2 малорастворимые хлориды | BaSO4, CaSO4, SrSO4 малорастворимые сульфаты | Al(OH)3, Zn(OH)2, Fe(OH)3, Cu(OH)2, Co(OH)2, Cr(OH)3, Sn(OH)2, Mg(OH)2, Cd(OH)2, Ni(OH)2 малорастворимые гидроксиды и HgO | |||
| Групповой реактив | конц. NaOH | конц. NH4OH | |||||
| Характер получаемых соединений | [Al(OH)4]- [Zn(OH)4]2- [Cr(OH)4]- [Sn(OH)4]2- | Fe(OH)3 Fe(OH)2 Mg(OH)2 Mn(OH)2 | [Cu(NH3)4]2+ [Co(NH3)4]2+[[Ni(NH3)4]2+ [Hg(NH3)4]2+ [Cd(NH3)4]2+ | ||||
Лабораторная работа 1
«Разделение смеси катионов Сu2+, Fe3+, Pb2+ и Ba2+ групповыми реагентами кислотно-основного метода»
Для анализа дан раствор, содержащий катионы Сu2+, Fe3+, Pb2+ и Ba2+ Необходимо разделить указанные катионы при помощи групповых реагентов кислотно-основного метода.
Окраска раствора _______________, что обусловлено присутствием в нем катионов Cu2+ (голубой цвет) и Fe3+ (желтый цвет).
Разделить катионы – это добиться такого положения, когда один катион связывается соответствующим анионом в нерастворимое соединение и переводится в осадок, а остальные катионы остаются в растворе.
Определите принадлежность катионов к аналитическим группам кислотно-основного метода:
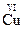 2+,
2+, 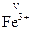 ,
, 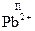 ,
, 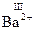
Обычно отделение начинают с катиона, номер аналитической группы которого наименьший (но не всегда).
1. К раствору прилейте 2н. раствор HCl – групповой реагент на 2-ую аналитическую группу. При этом протекает реакция:
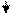
 Pb2+ + 2Cl- = PbCl2
Pb2+ + 2Cl- = PbCl2
крупнокристаллический
Образуется крупнокристаллический осадок хлорида свинца белого цвета. Осадок отфильтруйте, на фильтре PbCl2, в фильтрате (растворе) Сu2+, Fe3+ и Ba2+.
2. К фильтрату прилейте 2н. раствор H2SO4 – групповой реагент на 3-ю аналитическую группу. При этом образуется мелкокристаллический осадок сульфата бария по уравнению:

 Ba2+ + SO
Ba2+ + SO  = BaSO4 белый
= BaSO4 белый
Осадок отфильтруйте, на фильтре BaSO4, в фильтрате Сu2+ и Fe3+.
3. Для разделения Сu2+ и Fe3+ используется 25%-ный раствор NH4OH (избыток), который дает с Fe3+ осадок Fe(OH)3 красно-бурого цвета, а с Сu2+ образует комплексное соединение ярко синего цвета.
К фильтрату прилейте избыток 25%-ного раствора NH4OH: раствор приобретает ярко синюю окраску и образуется амфотерный осадок бурого цвета:
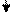
 Fe3+ + 3NH4OH =Fe(OH)3 + 3NH4 + Cu2+ + 4NH4OH = [Cu(NH3)4]2+ + 4H2O
Fe3+ + 3NH4OH =Fe(OH)3 + 3NH4 + Cu2+ + 4NH4OH = [Cu(NH3)4]2+ + 4H2O
гидроксид железа титрааммин меди – катион
Осадок отфильтруйте на фильтре Fe(OH)3, в фильтрате [Cu(NH3)4]2+. смесь разделена.
Лабораторная работа 2
