Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
СИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ (СГУПС)
дисциплина Б.2.5 «Химия»
кафедра «Химия»
методические рекомендации и перечень заданий для выполнения расчетно-графической работы по теме
«Растворы»
Специальность280700 «Техносферная безопасность»
Разработчик:
доцент Е.И. Никитина
(занимаемая должность) (подпись) (инициалы, фамилия)
Рассмотрены и утверждены на заседании кафедры «____» _________20___г. Протокол № _____
Заведующий кафедрой «Химия», профессор ( С.А. Шахов )
Г. Новосибирск – 2013 г.
Выписка из рабочей программы
учебной дисциплины Б.2.5 «химия»
СПЕЦИАЛЬНОСТЬ 280700 «ТЕХНОСФЕРНАЯ БЕЗОПАСНОСТЬ»
Расчетно-графическая работа (РГР)
Самостоятельная учебная работа (РГР) выполняется студентами по темам раздела «Растворы» по индивидуальным вариантам. Перечень вариантов РГР определяется и утверждается кафедрой. Номер варианта РГР для каждого студента определяется преподавателем. Результатом работы является отчет в виде комплексного текстового документа.
Общие положения и основные правила выполнения и защиты РГР по химии
Цель выполнения РГР – углубление знаний студентов по химии, развитие навыков решения прикладных задач.
Задачи РГР: закрепление теоретического материала по разделу «Растворы»; приобретение практических навыков решения прикладных задач; установление связей теоретического материала химии с ее прикладными задачами; приобретение навыков работы с научными, нормативными и справочными источниками; развитие творческих способностей студента.
Требования к структуре и оформлению РГР.Рекомендуемый объем пояснительной записки РГР – 10-15 листов. Отчет по расчетно-графической работе должен включать: титульный лист (см. Приложение 1), задание, оглавление, разделы (подразделы) основной части, список использованных источников, приложения (при необходимости), лист для рецензии преподавателя.
Оформление текстовой части должно соответствовать требованиям СТО СГУПС по оформлению курсовых и дипломных проектов (работ) для данного направления (специальности).
Выполненная РГР сдается на проверку в брошюрованном виде.
При сдаче на проверку РГР на титульном листе указываются фамилия исполнителя (с его подписью) и дата предоставления работы.
Порядок проведения защиты и критерии оценки РГР.
Результат предварительной оценки работы отражается на титульном листе в форме вывода: «К защите» или «Не допускается к защите». Замечания преподавателя указываются в рецензии. Срок предварительной оценки не должен превышать четырех рабочих дней.
К защите допускаются работы с наличием исправлений или ответа на указанные замечания. Если РГР не допускается к защите, она должна быть переработана студентом в соответствии с замечаниями и вновь представлена руководителю вместе с первым вариантом.
Защита РГР осуществляется в виде итогового собеседования с руководителем. При защите РГР учитываются:
- правильность решения задачи;
- самостоятельность и творческий подход к теме;
- логика аргументации и стройность изложения представленного материала;
- качество выполнения текстового материала;
- полнота, правильность и аргументированность ответов при защите работы;
- своевременность представления работы.
Руководитель на титульном листе делает запись «Зачтено» в случае успешной защиты студентом РГР или «Не зачтено» при неудовлетворительной защите. В обоих случаях указывается дата и ставится подпись преподавателя.
Повторная защита РГР разрешается не ранее, чем через сутки. Если студент три раза получает неудовлетворительную оценку по результатам защиты, то ему выдается новое задание.
При наличии незащищенной РГР, студент не допускается к сдаче зачета по химии.
Задание для выполнения расчетно-графической работы
Тема: «РАСтворы».
____________________________________ _________________ __________
(Ф.И.О. студента) (номер учебной группы) (№ варианта)
Таблица 1. Варианты расчетно-графической работы
| Номер варианта | Вещество | Концентрация вещества, моль/л | ||||||
| 1а | 2а | 3а | 4а | |||||
| CsOH | H2C2O4 | SrSO4 | Na2SO3 | 0,002 | 0,01 | 5∙10-5 | 0,03 | |
| HBr | HOBr | Agl | Na3BO3 | 0,002 | 0,04 | 5∙10-5 | 0,02 | |
| Sr(OH)2 | H3BO3 | MnS | K2S | 0,003 | 0,002 | 5∙10-5 | 0,04 | |
| RbOH | CH3COOH | PbI2 | Pb(NO3)2 | 0,004 | 0,08 | 5∙10-5 | 0,06 | |
| Ca(OH)2 | HCOOH | PbCl2 | Al2(SO4)3 | 0,001 | 0,06 | 5∙10-6 | 0,02 | |
| H2SO4 | NH4OH | BaCrO4 | NaNO2 | 0,008 | 0,08 | 5∙10-6 | 0,03 | |
| LiOH | H3PO4 | Ca3(PO4)2 | HCOOLi | 0,005 | 0,02 | 5∙10-6 | 0,009 | |
| HI | H2SO3 | CaCO3 | Na2SiO3 | 0,003 | 0,01 | 5∙10-6 | 0,07 | |
| Ba(OH)2 | HCN | CaSO4 | K2SO3 | 0,008 | 0,005 | 5∙10-3 | 0,08 | |
| HClO4 | NH4OH | MgCO3 | (NH4)SO4 | 0,005 | 0,07 | 5∙10-3 | 0,05 | |
| HCl | H2Se | Ag2SO4 | Na2CO3 | 0,002 | 0,002 | 5∙10-3 | 0,04 | |
| NaOH | H2SiO3 | BaSO4 | FeCl2 | 0,004 | 0,008 | 1∙10-5 | 0,03 | |
| KOH | HNO2 | Ag2CrO4 | Ba(NO2)2 | 0,006 | 0,02 | 1∙10-6 | 0,05 | |
| HNO3 | HAlO2 | FeS | KNO2 | 0,002 | 0,007 | 1∙10-5 | 0,02 | |
| HClO4 | HOCl | NiS | Ca(NO2)2 | 0,03 | 0,009 | 1∙10-6 | 0,02 | |
| LiOH | H2CO3 | Ag3PO4 | Na2S | 0,04 | 0,02 | 1∙10-6 | 0,03 | |
| Sr(OH)2 | H2SeO3 | ZnS | AlCl3 | 0,005 | 0,007 | 1∙10-6 | 0,04 | |
| HI | HF | CaF2 | K2CO3 | 0,03 | 0,04 | 1∙10-5 | 0,05 | |
| KOH | H2S | BaCO3 | NH4Cl | 0,07 | 0,01 | 1∙10-6 | 0,06 | |
| Ba(OH)2 | H3PO4 | PbSO4 | CrCl3 | 0,007 | 0,06 | 1∙10-4 | 0,08 | |
| CsOH | H2SO3 | Ag2SO4 | ZnCl2 | 0,005 | 0,06 | 1∙10-4 | 0,03 | |
| Ca(OH)2 | HCN | Ag2S | NiSO4 | 0,002 | 0,006 | 1∙10-4 | 0,09 | |
| H2SO4 | HAlO2 | CdS | NaCl | 0,006 | 0,008 | 2∙10-4 | 0,08 | |
| HBr | HNO2 | PbCO3 | Al2(SO4)3 | 0,02 | 0,07 | 2∙10-4 | 0,05 | |
| RbOH | HF | AgCl | (NH4)2SO4 | 0,007 | 0,02 | 2∙10-4 | 0,009 | |
| NaOH | HOCl | SrSO4 | Na2SO3 | 0,009 | 0,007 | 2∙10-3 | 0,005 | |
| LiOH | H3BO3 | AgI | CuSO4 | 0,006 | 0,02 | 7∙10-3 | 0,09 | |
| HCl | H2TeO3 | Ca3(PO4)2 | K2Se | 0,002 | 0,003 | 7∙10-3 | 0,008 | |
| HClO4 | H2Te | AgBr | Na2Te | 0,007 | 0,006 | 4∙10-4 | 0,06 | |
| HNO3 | NH4OH | PbCl2 | KCN | 0,04 | 0,009 | 5∙10-4 | 0,07 |
1. Из четырех веществ вашего варианта (столбцы 1-4) выберите сильные и слабые электролиты и составьте уравнение диссоциации их в водном растворе.
2. В столбце 1а даны значения молярных концентраций для растворов электролитов из столбца 1. Зная молярную концентрацию своего раствора, определите молярную концентрацию эквивалента, массовую долю, мольную (молярную) долю воды и растворенного вещества, моляльную концентрацию и титр раствора, если его плотность равна 1, 035г/см3.
3. Рассчитайте рН растворов электролитов из столбцов 1 и 2 для соответствующих концентраций, данных в столбцах 1а и 2а. Для раствора сильного электролита определите ионную силу раствора и активность катионов и анионов. Для раствора слабого электролита рассчитайте степень диссоциации по строгой и приближенной формулам Оствальда и сделайте вывод по полученным значениям. Напишите выражение для констант диссоциации слабого электролита по всем возможным ступеням.
4. В столбце 3 приведены малорастворимые электролиты. Напишите выражение для ПР малорастворимого электролита вашего варианта. Определите, можно ли приготовить раствор этого электролита молярной концентрации, указанной в столбце 3а. Вычислите, в каком объеме воды можно растворить 0,5 г данного малорастворимого вещества.
5. Напишите уравнение гидролиза соли, данной в столбце 4, по всем возможным ступеням и выражение для констант гидролиза по всем ступеням. Вычислите значения этих констант гидролиза.
6. Рассчитайте рН раствора соли из столбца 4, для концентрации, указанной в столбце 4а, учитывая только 1-ю ступень гидролиза. Укажите реакцию среды раствора. Определите, как будет изменяться рН раствора при нагревании и почему?
П р и м е ч а н и я:
Необходимые справочные данные приведены в табл. 2-5.
_______________________ __ до 15.05.2013__________ _до 25.05.2013_______
(дата выдачи задания) (срок сдачи на проверку) (срок защиты РГР)
Рекомендуемая литература
1. Н.Л. Глинка. Общая химия. – М.: КНОРУС, 2009.
2. Н.В. Коровин. Общая химия. – М.: Высшая школа, 2010.
3. Задачи и упражнения по общей химии: Учеб. пособие/ Под. ред. Н.В. Коровина. – М.: Высшая школа, 2004.
4. Н.Л. Глинка. Задачи и упражнения по общей химии. М.: «Интеграл-пресс», 2006.
5. И.А. Паули. Свойства растворов: Метод. указ. к практическим занятиям. – Новосибирск: Изд-во СГУПСа, 2004.
Таблица 2. Произведения растворимости труднорастворимых в воде
соединений (при 298 К)
| Вещество | ПР | Вещество | ПР |
| AgCl | 1,6∙10-10 | Fe2S 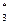 | 1,0∙10-88 |
| Ag2CrO4 | 1,1∙10-12 | MnS | 2,0∙10-15 |
| AgI | 9,7∙10-17 | SrSO4 | 3,2∙10-7 |
| Ag2SO4 | 7,7∙10-5 | NiS* | 1,1∙10-27 |
| AgBr | 4,4∙10-13 | PbCl2 | 2,12∙10-5 |
| Ag2S | 1,6∙10-49 | PbCO3 | 1,0∙10-13 |
| Ag3PO4 | 1,3∙10-20 | PbI2 | 9,8∙10-9 |
| Ca(OH)2 | 6,0∙10-6 | PbSO4 | 1,6∙10-8 |
| BaCrO4 | 2,3∙10-10 | PbS | 3,6∙10-29 |
| BaCO3 | 8,1∙10-9 | ZnS | 7,4∙10-27 |
| BaSO4 | 1,08∙10-10 | HgS* | 4,0∙10-58 |
| MgCO3 | 1,0∙10-5 | AgOH | 1,93∙10-8 |
| CaCO3 | 4,8∙10-9 | Al(OH)3 | 5,1∙10-33 |
| CaSO4 | 6,1∙10-5 | Cr(OH)3 | 6,7∙10-31 |
| CaF2 | 4,0∙10-11 | Fe(OH)3 | 3,8∙10-38 |
| CdS | 1,2∙10-28 | Mg(OH)2 | 5,5∙10-12 |
| CuS | 4,0∙10-38 | Ni(OH)2 | 1,6∙10-14 |
| FeS | 3,7∙10-19 | Cu(OH)2 | 5,0∙10-19 |
| Pb(OH)2 | 1,0∙10-15 | Ca3(PO4)2 | 1,0∙10-25 |
| Zn(OH)2 | 1,3∙10-17 |
ПР определены при 293 К.
Таблица 3. Константы диссоциации некоторых слабых электролитов в водных
растворах (при 298 К)
| Электролит | КД | Электролит | КД |
| Азотистая кислота HNO2 | 4,6∙10-4 | Циановодородная кислота HCN | 7,9∙10-2 |
| Алюминиевая кислота НAlO2 | 6,0∙10-13 | Щавелевая кислота Н2С2О4 | K1 = 5,4∙10-2 K2 = 5,4∙10-5 |
| Борная кислота H3BO3 | K1 = 5,8∙10-10 K2 =1,8∙10-13 K3 = 1,6∙10-14 | Аммония гидроксид NH4OH | 1,8∙10-5 |
| Бромноватистая кислота НОBr | 2,1∙10-9 | Вода | 1,8∙10-16 |
| Кремниевая кислота Н2SiO3 | K1 = 2,2∙10-10 K2 = 1,6∙10-12 | Алюминия гидроксид Аl(ОН)3 | K3 = 1,38∙10-9 |
| Муравьиная кислота НСООН | 1,8∙10-4 | Железа (II) гидроксид Fe(OH)2 | K2 =1,3∙10-4 |
| Селеноводородная кислота Н2Se | K1 = 1,7∙10-4 K2 = 1,0∙10-11 | Железа (III) гидроксид Fe(OH)3 | K2 =1,82∙10-11 K3 = 1,35∙10-12 |
| Сернистая кислота H2SO3 | K1 = 1,7∙10-2 K2 = 6,3∙10-8 | Меди гидроксид Cu(OH)2 | K2 =3,4∙10-7 |
| Сероводородная кислота Н2S | K1 = 1,1∙10-7 K2 = 1,0∙10-14 | Никеля гидроксид Ni(OH)2 | K2 =2,5∙10-5 |
| Теллуристая кислота H2TeО3 | K1 = 3,0∙10-3 K2 = 2,0∙10-8 | Серебра гидроксид AgOH | 1,1∙10-4 |
| Теллуроводородная кислота H2Te | K1 = 1,0∙10-3 K2 = 1,0∙10-11 | Свинца гидроксид Pb(OH)2 | K1 = 9,6∙10-4 K2 = 3,0∙10-8 |
| Угольная кислота Н2СО3 | K1 = 4,5∙10-7 K2 = 4,8∙10-11 | Хрома гидроксид Cr(OH)3 | K3 = 1,0∙10-10 |
| Уксусная кислота СН3СООН | 1,8∙10-5 | Цинка гидроксид Zn(OH)2 | K1 = 4,4∙10-5 K2 = 1,5∙10-9 |
| Хлорноватистая кислота НОСl | 5,0∙10-8 | Кадмия гидроксид Cd(OH)2* | K2 = 5,0∙10-3 |
| Фосфорная кислота H3PO4 | K1 = 7,5∙10-3 K2 = 6,3∙10-8 К3 = 1,3∙10-12 | Марганца гидроксид Mn(OH)2* | K2 = 5,0∙10-4 |
| Фтороводородная кислота HF | 6,6∙10-4 |
КД определены при 303 К
Таблица 4. Коэффициенты активности ионов в водных растворах (при 298 К)
| Ионная сила раствора I | Заряд иона z | ||
| ±1 | ±2 | ±3 | |
| 0,001 | 0,98 | 0,78 | 0,73 |
| 0,002 | 0,97 | 0,74 | 0,66 |
| 0,005 | 0,95 | 0,66 | 0,55 |
| 0,01 | 0,92 | 0,60 | 0,47 |
| 0,02 | 0,90 | 0,53 | 0,37 |
| 0,05 | 0,84 | 0,50 | 0,21 |
| 0,07 | 0,83 | 0,36 | 0,25 |
| 0,1 | 0,81 | 0,30 | 0,21 |
| 0,2 | 0,80 | 0,41 | 0,14 |
| 0,3 | 0,81 | 0,42 | 0,14 |
| 0,4 | 0,82 | 0,45 | 0,17 |
| 0,5 | 0,84 | 0,50 | 0,21 |
Таблица 5. Сильные и слабые электролиты*
| Сильные | Слабые |
| 1. Все растворимые соли, кроме CdI2; HgCl2; Hg(CN)2; Fe(CNS)3 | 1. Все труднорастворимые соли |
| 2. Неорганические кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO3, HClO4, H2CrO4, H2Cr2O7, HMnO4 | 2. Неорганические кислоты: H2S, HCN, HF, HNO2, H2SO3, H3PO4, HClO, HClO2, H2ZnO2, H2CO3, HCrO2, H2SiO3, H3BO3, H3PO3, H3AsO4, H3SbO3 |
| 3. Щелочи: LiOH,NaOh, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2 | 3. Все нерастворимые гидроксиды, а также NH4OH, H2O |
| 4. Все органические кислоты: HCOOH, CH3COOH и др. |
* Cледует помнить, что такое деление на сильные и слабые электролиты условно, так как степень диссоциации слабых электролитов зависит от концентрации раствора и возрастает с разбавлением раствора.
ПРИЛОЖЕНИЕ 1
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
СИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ (СГУПС)
дисциплина «Химия»
кафедра «Химия»
