ПРАКТИЧЕСКИЕ РАБОТЫ по применению инфракрасной спектроскопии в химии координационных соединений для студентов дневного и вечернего отделений химического факультета РГУ
Александр Александрович ШВЕЦ
Колебательные переходы и соответствующие им колебательные спектры молекул можно получить как при непосредственном поглощении веществом инфракрасного излучения (диапазон волн 2 - 50 мкм), так и при поглощении видимого и ультрафиолетового излучения. В последних случаях лишь часть поглощенной энергии расходуется на возбуждение молекул, большая часть реэмиттируется веществом. В соответствии с этим колебательная спектроскопия разделяется на инфракрасную (ИК) и спектроскопию комбинационного рассеяния (КР).
Вследствие простоты получения спектров и технического совершенства приборов наибольшее распространение получил метод ИК спектроскопии. Однако часто необходимым оказывается совместное применение обоих методов.
Как и всякое движение на молекулярном уровне, колебания молекул необходимо рассматривать методом квантовой механики. Однако многие частные вопросы, в частности вопрос о частоте колебаний молекулы, можно решить, рассматривая молекулу как механическую систему, например, как системы шаров, символизирующих атомы, и связывающих их пружин, символизирующих связи между атомами. Тогда колебания вдоль линии связи, соединяющей два атома, можно описать законом Гука, который позволяет вычислить частоту колебаний системы:
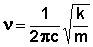 (1)
(1)
где ν - частота колебаний (более точно - волновое число, имеющее размерность см-1);
C - скорость света;
K - силовая постоянная связи;
m - приведенная масса системы, вычисляемая через массы атомов по формуле 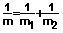 .
.
Силовая постоянная К увеличивается с возрастанием прочности связи между атомами.
С помощью этого уравнения можно ориентировочно подсчитать частоту колебаний световой волны, поглощаемой какой-либо связью, оценить направление изменения этой частоты с изменением массы атомов, образующих связь, с увеличением или уменьшением прочности связи оценить влияние таких факторов, как межмолекулярное взаимодействие, водородная связь и т.д.
Энергия в колебательных движениях молекул квантована. Ее величина для так называемого гармонического осциллятора может быть найдена из выражения:
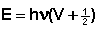 (1)
(1)
где V - колебательное квантовое число, принимающее значения натуральных чисел: 0, 1, 2, ...
ν- частота основного колебания, определяемая уравнением (1).
Выражению (2) отвечает система равноотстоящих уровней энергии (рис. 1).
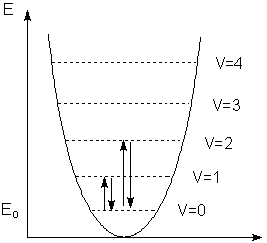
Рисунок 1.
При V = 0 Е = 1/2·hν, что указывает на безизлучательные колебательные движения молекул, находящейся даже на нулевом колебательном уровне. При поглощении кванта излучения молекула переходит на более высокий колебательный уровень. Большинство регистрируемых спектрометром полос поглощения обусловлено переходом Vо ––> V1.
Молекула, подчиняющаяся модели гармонического осциллятора, меняет колебательное квантовое число только на единицу, т.к. ΔV = ±1 . Реальные молекулы являются в большей или в меньшей степени ангармоническими осцилляторами, частота колебаний которых зависит и от амплитуды. В реальных молекулах возможны переходы на уровни V2, V3, например, переход Vо ––> V2, называемый первым обертоном. Однако интенсивность даже первого обертона на порядок ниже интенсивности основного перехода. Не всякое колебание молекул, приводит к появлению полосы поглощения в спектре ИК. Если при этом изменяется распределение электрического заряда и молекула представляет собой колеблющийся диполь, то такое колебание активно в ИК спектре. Интенсивность поглощения в ИК спектре прямо пропорциональна квадрату первой производной дипольного момента ею межъядерному расстоянию. Такие полярные молекулы, как HCl, имеют наиболее интенсивные полосы в ИК спектре. В спектрах КР проявляются те колебания, при которых происходит изменение поляризуемости молекулы. Интенсивность линий КP пропорциональна квадрату производной поляризуемости молекулы по межъядерному расстоянию. Колебания таких неполярных гомоядерных молекул как Н2, N2, О2 активны только в спектрах КР. В молекулах, имеющих центр симметрии (например, в квадратно-плоскостном ионе [PtCl4]2-), любое колебание активно либо только в ИК, либо только в КР спектрах. В таких случаях ИК и КР спектры удачно дополняют друг друга. В молекуле, имеющей N атомов, возможны 3N - 6 основных колебаний (3N - 5 для линейных молекул). Сложная молекула представляет собой набор взаимодействующих осцилляторов. Чем больше атомов в молекуле, тем сложнее перераспределение энергии по связям, вовлеченных в колебание.
Точная интерпретация спектров сложных молекул требует трудоемкого анализа колебаний и сложных расчетов. Поэтому спектры ИК часто интерпретируются на основе привлечения некоторых эмпирических закономерностей. При такой интерпретации спектров молекул важнейшим понятием оказывается понятие характеристичности колебаний. При сравнении большого числа спектров различны молекул обнаружено, что колебательные полосы определенных групп атомов имеют приблизительно одинаковые частоты и мало зависят от характера окружающих их групп. Такие полосы поглощения называются характеристическими. Энергия характеристического колебания сосредоточена в основном на одной определенной связи, так что ковалентную связь некоторых атомов А-В в молекуле можно рассматривать как некоторую независимую молекулу и ее частоту рассчитать по уравнению (1), не учитывая того, что и другие атомы входят в молекулу, а энергия колебаний обусловлена другими, кроме А и В, атомами. Характеристическими являются колебания с участием атомов водорода и дейтерия, а также с участием группировок, содержащих двойные и тройные связи - OH, NH, SH, CH, C=C, C=O, C=N, C=C=O, N=O, S=O, P=O и др. Наборы частот характеристических колебаний сведены в корреляционные таблицы. Колебания подразделяются на валентные, при которых преимущественно изменяются длины связей, и деформационные, при которых наибольшее изменение характерно для величин валентных углов. Валентные колебания подразделяется на симметричные и асимметричные, а деформационные на крутильные, ножничные, маятниковые и др.
Важнейшими характеристиками полосы поглощения являются следующие (рис.2):
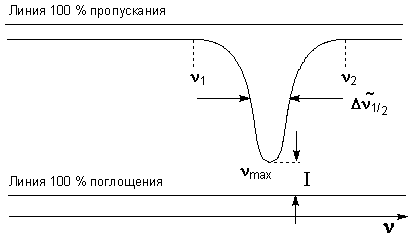
Рисунок 2.
1) частота колебания (более точно - волновое число) в максимуме поглощения νmax;
2) пиковая интенсивность в максимуме поглощения и связанные с ней величины - оптическая плотность D и кажущийся коэффициент экстинкции ε;
D = lg(Iо/I)
D = ε·C·l
3) ширина полос поглощения (иногда называют полушириной) ширина полосы, выраженная в см-1 на середине ее высоты, когда последняя выражена в единицах относительной плотности, т.е. когда D = 0,5·Dmax
4) интегральная интенсивность, вычисляемая по формуле (3)
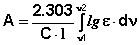 (3)
(3)
Здесь С - концентрация, l - длина поглощающего слоя.
Для полос поглощения, описываемых уравнением Лоренца, интегральная интенсивность может быть рассчитана по уравнению (4):
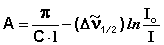 (4)
(4)
В более сложных случаях необходимо проводить графическое интегрирование.
ВОПРОСЫ ДЛЯ КОЛЛОКВИУМА И ЛИТЕРАТУРА
Ниже приводится тот объем сведения, который необходим для выполнения практических заданий по колебательным спектрам координационные соединений.
2.1. Элементы теории колебательных спектров
Колебания двухатомных молекул. Колебания многоатомных молекул. Характеристичность. Изотопный сдвиг. Симметрия колебаний.
Литература:
1. Р. Драго. Физические методы в химии. - Том I, 1981.
2. Дж. Бранд. Г. Эглинтон. Примененение спектроскопии в органической химии. - М.: Мир, 1967. С.34 - 50.
3. А. И. Григорьева. Введение в колебательную спектроскопию неорганических соединений. - М., 1977. С.3-34.
4. К. Накамото. Инфракрасные спектры неорганических и координационных соединений. - М., 1966. С.15-102.
5. А. А. Бабушкин и др. Методы спектрального анализа. - М., 1962. С. 172-190.
В некоторой степени источники взаимозаменяемы. Для ознакомления с методами расчета колебаний молекул можно рекомендовать монографию Г.С.Коптев, Ю.А.Пентин. Расчет колебательных молекул. - М., 1978, а также указанную там литературу.
2.2. Колебательная спектроскопия в химии координационных соединений
Функциональный анализ, идентификация координационных соединений. Количественный анализ, установление состава, нахождение константы устойчивости комплексов. Кинетика реакций в координационной химии.
Литература:
1. А. Кросс. Введение в практическую инфракрасную спектроскопию. - М., 1961. С.57 - 62, 18 - 22, 75 - 107.
2. К. Наканиси. Инфракрасные спектры и строение органических, соединений - М., 1965. С. 21-78.
3. Дж. Бренд, Г. Эглинтон. Применение спектроскопии в органической химии. - М., 1967. C.115 - 186.
4. Н. А. Казицина, Н. Б. Куплетская. Применение УФ, ИК, ЯМР спектроскопии в органической химии. - М., 1979.
5. Б. В. Иоффе, Р. Р. Костиков, В. В. Разин. Физические методы определения строения органических молекул. - Л., 1976. С.13-28.
6. А. А. Бабушкин и др. Методы спектрального анализа. - М., 1962. С.246 - 284.
7. Е. Н. Гурьянова. Донорно-акцепторная связь. - М., 1973.С.62 - 65, 150 - 158.
Источники 1 - 6 в значительной мере взаимозаменяемы.
2.3. Колебательная спектроскопия в химии координационных соединений (продолжение)
Спектральные доказательства образования донорно-акцепторной связи. Локализфция координационной связи. Конкурентная координация. Связи между колебательными спектрами и пространственным строением комплексов. Колебательная спектроскопия и природа связи в координационных соединениях. Особенности спектров внутрикомплексных соединений. Вода в комплексах. Связь между термодинамическими характеристиками и спектральными характеристиками координационных соединений. Методы приближенной оценки ocновности органических лигандов.
Литература:
1. Спектроскопические методы в химии координационных соединений. Под ред. В. М. Вдовенко. - М./Л., 1964. С.120 - 164. 172 - 189.
2. K. Накамото. Инфракрасные спектры неорганических и координационных соединений. - М., 1966. С. 195 - 319.
3. Современная химия координационных соединений / Под ред. Дж. Льюиса и Р. Уилкинса. - М., 1963. С.305 - 358,
4. А. Финч и др. Применение длинноволновой ИК-спектроскопии в химии. - М., 1973. С.125 - 184.
Указанные источники 1 - 3 в некоторой степени взаимозаменяемы.
2.4. Техника спектроскопических измерений
Принцип работы ИК- и КР-спектрометров. Материалы кювет и призм. Техника приготовления образцов. Растворители. Оптимальные условия регистрации ИК-спектров. Калибровка спектрометров.
Литература:
1. А. Кросс. Введение в практическую инфракрасную спектроскопию, - М., 1961. С.24 - 36.
2. А. А. Бабушкин и др. Методы спектрального анализа. - М., 1962, С.201 - 235.
3. Современная химия координационных соединений, под ред. Дж. Льюиса и Р. Уилкинса. - М., 1963; С.293 - 304.
4. А. И. Александров, В. Никитин. Успехи физических наук (журнал), 56, 3 (1955).
Источники 1 - 3 в некоторой степени взаимозаменяемы. Источник 4 посвящен вопросам точной калибровки спектрофотометров.
