На основании следствия из закона Гесса
ФЕДЕРАЛЬНОЕ АГЕНСТВО ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА
Филиал государственного образовательного учреждения высшего профессионального образования
«Иркутский государственный университет путей сообщения»
в г. Красноярске
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
РАВНОВЕСИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
Методические указания к лабораторным работам
для студентов первого курса всех специальностей
Красноярск 2006
УДК 54
ББК 24.1
Энергетика химических реакций. Кинетика химических реакций. Равновесие химических реакций.: Методические указания к лабораторным работам для студентов первого курса всех специальностей – Красноярск: филиал ИрГУПС в г. Красноярске, 2006, 33с.
Составитель: Людмила Александровна Рубчевская
Рецензенты: Смелый В.В., к.т.н., доцент кафедры
общепрофессиональных дисциплин филиала ИрГУПС
в г. Красноярске.
Тюменева Г.Т., к.т.н., доцент кафедры химии КрасГАСА
Печатается по решению методического совета филиала Иркутского государственного университета путей сообщения в г. Красноярске
© Филиал Иркутского государственного университета путей сообщения в г. Красноярске, 2006
ЛАБОРАТОРНАЯ РАБОТА 1
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: ознакомиться с методом определения теплового эффекта реакции нейтрализации
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ
Обмен энергией между изучаемой системой и внешней средой описывают законы, которые изучает термодинамика. Применение законов термодинамики в химии позволяет решить вопрос о принципиальной возможности различных процессов, условиях их осуществления, определить степень превращения реагирующих веществ в химических реакциях и оценить их энергетику.
Системойназывают вещество или совокупность веществ, которые подвергаются теоретическому или экспериментальному изучению, например, кристаллы, раствор соли, газ в цилиндре. Внешняя среда - вещества, окружающие систему.
Обмен энергией между системой и внешней средой может осуществляться в различных формах: тепловая, механическая, электрическая энергия, энергия излучения могут превращаться друг в друга. В превращениях, происходящих в ходе химических реакций, участвуют, как правило, тепловая энергияQи механическая(или работа А). Тепловая и механическая энергия - алгебраические величины. Знаки величин Qи Ав термодинамике рассматриваются по отношению к системе. Энергия, получаемая системой, обозначается знаком « + », отданная системой - знаком «−».
Переменные величины, определяющие состояние системы, называются параметрами состояния. Среди них в химии наиболее часто используются давление, температура, объём, состав системы. Состояние системы и происходящие в ней изменения характеризуются также с помощью термодинамических функций,зависящих от параметров состояния и не зависящих от пути перехода системы из одного состояния в другое. К ним относятся внутренняя энергия, энтальпия, энтропия, изобарно-изотермический потенциал и др.
Внутренняя энергия, энтальпияи тепловой эффект
реакции
Внутренняя энергиясистемы U- это ее полная энергия, состоящая из кинетической энергии (энергия поступательного, колебательного и вращательного движения) и потенциальной энергии (энергия притяжения и отталкивания) всех частиц системы, исключая потенциальную и кинетическую энергию системы как целого. Определить можно лишь изменение внутренней энергии D U = U2 – U1,где U2и U1 — внутренняя энергия системы в состоянии 2 и 1 соответственно.
Если система обменивается с внешней средой тепловой энергией Qи механической энергией (или работой) Аи при этом переходит из состояния 1 в состояние 2, то согласно первому началутермодинамики,являющемуся следствием закона сохранения энергии, количество энергии, которое выделяется или поглощается системой в форме теплоты Q и работы А, т. е. Q + A, равно изменению полной энергии системы, т. е. DU, при переходе системы из одного состояния в другое:
DU = Q + A.
Иными словами, изменение внутренней энергии DU системы, переходящей из состояния 1 в состояние 2, есть алгебраическая сумма всех энергий, обменивающихся с внешней средой.
Для химической реакции в общем виде aА + bВ ® mM + dDтепловым эффектом (теплотой)Qпри температуре Т называется тепловая энергия, которая выделяется или поглощается при взаимодействии исходных веществ А и В в стехиометрических соотношениях с образованием продуктов М и D; исходные вещества и продукты реакции находятся при одной и той же температуре Т. Реакции, которые сопровождаются выделением теплоты, называются экзотермическими, а те, которые сопровождаются поглощением теплоты, - эндотермическими.
Тепловой эффект реакции при постоянном объеме и температуре Т равен Qv, при постоянном давлении и температуре Т - Qp.
В ходе химических реакций совершается в основном работа против сил внешнего давления, которая зависит от изменения объема системы. С учетом принятых в термодинамике условий знаков, работа положительна, если система ее получает (DV < 0), и отрицательная, если система совершает работу против сил внешней среды (DV > 0).
Для изохорного процесса, поскольку объем системы не изменяется (V = const), A = 0. Следовательно,
∆U = Qv.
Тепловой эффект реакции при постоянном объеме и температуре Т соответствует изменению внутренней энергии системы в ходе реакции.
Примеры реакций, протекающих при постоянном объеме, - реакции в закрытом сосуде (автоклаве), между твердыми и жидкими веществами без выделения газов, между газами, если их количество не меняется.
Для изобарных процессов
А = - р∆V = - p(V2 – V1),следовательно, DU = Qp - pDV,
или U2 – U1 = Qp - р(V2 - V1), откуда следует, что Qp = (U2 + рV2) – (U1 + рV1).
Функция U + pV,обозначенная через H, называется энтальпией (теплосодержанием). Энтальпия есть функция состояния. Введя обозначение U + pV= H,получаем
Qp = H2 - H1 = DH.
Тепловой эффект реакции при постоянном давлении и температуре Т соответствует изменению энтальпии системы в ходе реакции.
Для экзотермической реакции DU < 0, DH < 0; для эндотермической реакции DU > 0, DH > 0.
Стандартные условия и стандартное состояние.
Стандартная энтальпия образования
Тепловой эффект реакции зависит от природы исходных веществ и продуктов реакции, их физического состояния, условий
(Т, р), а также от количества веществ, участвующих в реакции. Поэтому, чтобы тепловые эффекты различных реакций можно было сравнивать, необходимо точно указать условия, при которых эти реакции протекают и физическое состояние каждого компонента реакции. Предполагается также, что исходные вещества и продукты реакции взяты в стехиометрических количествах.
Обычно термодинамические величины определяют при стандартных условиях:р = 101 кПа (точнее, 101,32 кПа) и Т = 298 К (точнее, 298,15 К).
В большинстве случаев реакции протекают при постоянном давлении, поэтому важными величинами для термохимических расчетов являются энтальпии (теплоты) образования соединений. Они позволяют рассчитывать тепловые эффекты большого числа различных реакций. По энтальпиям образования можно судить также об устойчивости соединений относительно их распада на простые вещества.
Энтальпия (теплота) образования соединения— этоизменение энтальпии (тепловой эффект) реакции образования 1 моль этого соединения из простых веществ. Энтальпии образования соединений относят к определенным условиям (р, Т)и выбирают определенные стандартные состояния для простых веществ.
Стандартная энтальпия (теплота) образования соединенияравна изменению энтальпии (тепловому эффекту) реакции образования 1 моль этого соединения при р= 101 кПа и данной температуре Тиз простых веществ, находящихся в стандартном состоянии. Эта величина выражается в килоджоулях на моль (кДж/моль).
За стандартное состояниевещества принимают такое его физическое состояние, в котором чистое вещество наиболее устойчиво при р = 101 кПа и определенной постоянной температуре Т. Температура может быть любой постоянной, но чаще всего это 298 К. Для твердых веществ наиболее устойчивым состоянием при давлении 101 кПа и температуре 298 К является кристаллическое, которое и принимается за стандартное. Для газов стандартное состояние — это состояние идеального газа при давлении 101 кПа. Для растворенных веществ и ионов за стандартное состояние принимают состояние при молярной концентрации раствора равной 1 моль/л; предполагается, что раствор обладает свойствами бесконечно разбавленного раствора.
Если вещество при стандартных условиях может существовать в нескольких аллотропных формах, за стандартное состояние принимается более устойчивая при этих условиях форма. Так, для углерода при стандартных условиях более устойчивой модификацией является графит. Он и принимается за стандартное состояние углерода в этих условиях. По той же причине за стандартное состояние для серы принимается ромбическая сера, для кислорода газообразный молекулярный кислород. и т.д.
Стандартную энтальпию образования соединения чаще всего определяют при 298 К. Данная величина обозначается DH0обр, 298 или DH0ƒ, 298, где верхний индекс означает стандартное состояние, один из нижних индексов указывает теплоту образования, а другой – значение температуры. Так, стандартная энтальпия газообразного СО2 при 298 К DH0ƒ,СO 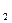 , 298 = -396 кДж/моль представляет собой изменение энтальпии реакции С (графит) + О2 (г) ® СО2 (г), протекающей при давлении 101 кПа и температуре 298 К. Энтальпия образования простых веществ в стандартном состоянии принимается равнойнулю,
, 298 = -396 кДж/моль представляет собой изменение энтальпии реакции С (графит) + О2 (г) ® СО2 (г), протекающей при давлении 101 кПа и температуре 298 К. Энтальпия образования простых веществ в стандартном состоянии принимается равнойнулю,
т. е. DH0ƒ,O 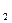 , 298= 0, DH0ƒ, С
, 298= 0, DH0ƒ, С  , 298 = 0. Стандартные теплоты образования определены для нескольких тысяч веществ и сведены в справочники.
, 298 = 0. Стандартные теплоты образования определены для нескольких тысяч веществ и сведены в справочники.
Энтальпия образования соединений может быть как отрицательной, так и положительной. Используя значения стандартных энтальпий образования соединений, можно сравнивать устойчивость соединения и простых веществ, из которых оно образовалось, а также устойчивость различных между собой соединений.
Если стандартная энтальпия образования отрицательна, соединение более устойчиво, чем простые вещества, из которых оно образовалось. Если она положительна, соединение менее устойчиво, чем простые вещества, образовавшие его.
Эндотермические соединения (DH0ƒ, 298 > 0) неустойчивы и склонны к распаду. Получают их, как правило, не прямым синтезом из простых веществ, а косвенным путем.
В ряду однотипных соединений чем меньше стандартная энтальпия образования соединения DH0ƒ, 298, тем больше его термическая устойчивость относительно разложения на простые вещества. Так, ZnO (DH0ƒ, 298 = - 350,6 кДж/моль)более устойчив, чем CdO (DH0ƒ, 298 = - 260 кДж/моль), а CdO более устойчив, чем HgO (DH0ƒ, 298 = - 90,9 кДж/моль).
Стандартные энтальпии образования некоторых веществ приведены в таблице 1.
Таблица 1
Стандартные теплоты (энтальпии) образования некоторых веществ
| Вещество | Состояние | DH0ƒ, 298, кДж/моль |
| N2 | г | |
| HI | г | + 25,94 |
| NH3 | г | - 46,19 |
| C2H2 | г | + 226,75 |
| C6H6 | ж | + 49 |
| Fe | к | |
| Fe2O3 | к | - 822,2 |
| H2 | г | |
| O2 | г | |
| Cu | к | |
| NaOH | к | - 426,6 |
| CuSO4 | к | - 770,9 |
| CuSO4·5H2O | к | - 2275,4 |
| H2SO4 | ж | - 811,7 |
| H2O | ж | - 285,84 |
| H2O | г | - 241,8 |
| Cr2O3 | к | - 1140 |
| HCI | р | - 91,8 |
| H+ | р | |
| OH- | р | - 229,94 |
| CO2 | г | - 393,51 |
| HNO3 | ж | -173,00 |
| Na2O | к | - 430,6 |
| CH4 | г | - 74,85 |
| C3H8 | г | - 104,0 |
| H2O | к | - 235,5 |
| NH4OH | р | - 361,2 |
| N2O | г | + 82,01 |
Термохимические уравнения. Закон Гесса.
Термохимические расчеты.
Термохимические уравнения— это химические уравнения, в которых указан тепловой эффект (изменение энтальпии DН) реакции и физическое состояние или модификация исходных веществ и продуктов реакции (г - газообразное, ж – жидкое, к – кристаллическое, т – твердое, р – растворенное и др.). Если агрегатные состояния или модификации исходных веществ для условий реакции очевидны, например O2, N2, NH3, Al2O3 и другие при 298 К, то их можно не указывать.
Термохимические расчеты основаны на применении закона Гесса (1836 г.), который формулируется так: тепловой эффект химической реакции при постоянном давлении или объеме не зависит от способа ее проведения, а зависит лишь от начального и конечного состояний реагирующих веществ.Отсюда если химический процесс проходит в несколько стадий, то общий тепловой эффект процесса равен сумме тепловых эффектов промежуточных стадий.
Пример 1.Железо, реагируя с кислородом, может образовывать сразу Fe 2O3:
2Fe (к) + 3/2 O2 (г) = Fe2O3 (к), DН 1 = - 822,2 кДж. (1)
Эта же реакция может пройти в две стадии. Сначала железо окисляется до закиси:
2Fe (к) + O2 (г) = 2FeO (к), DН 2 = - 529,6 кДж, (2)
затем один оксид железа переходит в другой по уравнению
2FeO (к) + 1/2 O2 (г) = Fe2O3 (к), DН 3 = - 292,6 кДж. (3)
Согласно закону Гесса сумма тепловых эффектов реакций (2) и (3) должна быть равна тепловому эффекту реакции (1), что действительно имеет место:
DН 1 = DН 2 + DН 3 = - 529,6 кДж + (-292,6 кДж) = - 822,2 кДж.
Чтобы отнести энтальпию реакции к одному молю какого либо вещества, термохимические уравнения, как видно из примера 1, иногда имеют дробные коэффициенты.
Закон Гесса дает возможность, пользуясь термохимическими уравнениями, вычислить тепловые эффекты реакций в тех случаях, когда их измерить непосредственно в калориметре или трудно, или совсем невозможно.
Пример 2. Измерить экспериментально тепловой эффект превращения графита в алмаз невозможно, но, пользуясь законом Гесса, этот эффект можно рассчитать, применив обыкновенные алгебраические действия. Известно, что и графит и алмаз сгорают в атмосфере кислорода с образованием одного и того же конечного продукта - углекислого газа, но с выделением разного количества теплоты:
С (графит) + О2 (г) = СО2 (г), DН1 = - 393,4 кДж,
С (алмаз) + О2 (г) = СО2 (г), DН2 = - 395,28 кДж.
Вычтем из первого уравнения второе и проведем сокращение. Получим С (графит) = С (алмаз), DН3 = + 1,88 кДж, т. е. графит превращается в алмаз с поглощением тепла.
Для расчета энтальпии реакции применяется также следствие из закона Гесса, которое формулируется следующим образом:
Тепловой эффект (изменение энтальпии) реакции DH реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, умноженных на соответствующие стехиометрические коэффициенты.
Обычно определяют изменение стандартной энтальпии реакции по стандартным энтальпиям образования продуктов и исходных веществ при 298 К:
DH0298 реакции =å  DH0ƒ,
DH0ƒ, 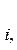 298 продуктов - å
298 продуктов - å  DH0ƒ,
DH0ƒ, 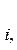 298 исходных веществ,
298 исходных веществ,
где 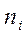 - стехиометрические коэффициенты.
- стехиометрические коэффициенты.
Для реакции в общем виде аА + bB = mM + dD
DH0298 реакции = [m DH0ƒ, 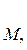 298 + dDH0ƒ,
298 + dDH0ƒ,  298] - [аDH0ƒ,
298] - [аDH0ƒ,  298 + bDH0ƒ,
298 + bDH0ƒ, 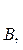 298]
298]
Следствие из закона Гесса позволяет определять как тепловой эффект реакции по известным энтальпиям образования веществ, участвующих в реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
Пример 3. Рассчитать стандартный тепловой эффект реакции
CH4 + 2H2O (г) = CO2 + 4H2,
если известны стандартные энтальпии образования веществ (см.табл. 1). Записать термохимическое уравнение реакции.
На основании следствия из закона Гесса
DH0298 реакции = [DH0ƒ,  , 298 + 4 DH0ƒ,
, 298 + 4 DH0ƒ, 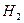 , 298] – [DH0ƒ,
, 298] – [DH0ƒ,  , 298 + 2 DH0ƒ,
, 298 + 2 DH0ƒ,  , 298]
, 298]
Подставив значения стандартных энтальпий образования веществ с учетом их физического состояния, получим
DH0298 реакции = – 1· 393,51 + 4· 0 – 1(– 74,85) – 2(241,82) = + 164,98 кДж/моль.
Термохимическое уравнение имеет вид
CH4 + 2H2O (г) = CO2 + 4H2 , DH0298 реакции = + 164,98 кДж/моль.
