Маскирование мешающих ионов
Органические реагенты используются для маскирования мешающих ионов. При этом они образуют устойчивые хелатные комплексы с мешающим ионом. Например, для маскирования Fe3+, который мешает открытию многих ионов, используют из органических реагентов винную кислоту или лимонную кислоту. Очень хороший маскирующий реагент ЭДТА, который маскирует почти все элементы, кроме Ве, образуя прочные комплексы в растворе. Лимонная кислота H3C6H5O7 или HОС(CH2COOH)2COOH взаимодействует с Fe(OH)3, образуя нейтральный комплекс, достаточно устойчивый в растворе, железа(III)цитрата тригидрат C6H5O7Fe 3H2O. Это красно-коричневое твердое аморфное вещество, растворимое в воде, не растворяется в этаноле.
Отделение мешающих ионовСпецифических органических реагентов, используемых для процессов отделения и разделения, очень немного. Как правило, эти реагенты участвуют в таких процессах отделения как: осаждение, хроматография, экстракция. Отделение мешающих ионов осаждением действием группового реагентаСреди органических групповых реагентов можно выделить купферон(аммонийная соль N-нитрозо-N-фенилгидроксиламина): Купферон легко растворим в воде, так как в его молекуле содержится нитрозо - группа (O=N-) и анионный атом кислорода. В купфероне группа NH4+ может замещаться на ион металла, который координируется с группой - NO через кислород. Этим групповым реагентом осаждаются из кислого раствора очень многие ионы (Fe3+, Ti4+, Zr4+, Hf4+, Movi, Sn2+, 4+, Sb3+, Fe2+), а большинство двухзарядных катионов металлов остаются в растворе. 8-оксихинолин (оксин)в ацетатном буферном растворе позволяет отделить (осадить) большинство металлов от щелочных и щелочноземельных металлов. Из аммиачно-щелочных растворов осаждаются щелочноземельные металлы, а в растворе останутся платиновые металлы, Со, Ni, Ag, Au, Mo, W, V. Экстракционное отделение мешающих ионовБолее эффективное отделение ( разделение ) достигается при использовании экстракции хелатов определяемых элементов, плохо растворимых в воде, но хорошо растворимых в органических растворителях. В качестве органических растворителей для экстракции хелатов используют (инертные) растворители: хлороформ CHCl3 (трихлорметан), тетрахлоруглерод CCl4 (тетрахлорметан); полярные растворители: метилизобутилкетон CH3-CO-CH(CH3)-CH2-CH3,аетилацетон ( 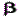 -дикетон ; 2,4-пентандион) CH3COCH2COCH3. Ацетилацетон выделяется среди других органических реагентов тем, что он используется как в виде раствора в различных органических растворителях (ССl4, CHCl3, C6H6), так и самостоятельно. Для ацетилацетона известно более 50 хелатов с катионами. Ацетилацетонаты большинства металлов лучше растворяются в органических растворителях, чем другие хелаты. Метод экстракцииоснован на том, что вещество неодинаково распределяется между двумя жидкими фазами, не смешивающимися между собой. Обычно вода и органический растворитель.
-дикетон ; 2,4-пентандион) CH3COCH2COCH3. Ацетилацетон выделяется среди других органических реагентов тем, что он используется как в виде раствора в различных органических растворителях (ССl4, CHCl3, C6H6), так и самостоятельно. Для ацетилацетона известно более 50 хелатов с катионами. Ацетилацетонаты большинства металлов лучше растворяются в органических растворителях, чем другие хелаты. Метод экстракцииоснован на том, что вещество неодинаково распределяется между двумя жидкими фазами, не смешивающимися между собой. Обычно вода и органический растворитель.
Растворимость хелатовРастворимость хелата в воде зависит от наличия в молекуле свободных гидрофильных групп. Гидрофильными являются все полярные группы, такие как -OH, - NH2, - SO3- , -COO- группы со свободной парой электронов, которые могут ориентировать протоны и молекулы воды. Хелатообразующими группами в реагентах являются гидрофильные группы. При образовании хелатов эти группы благодаря образованию связей с металлами насыщаются. Если после этого у реагента не остается больше заряженных и гидрофильных групп, то можно ожидать, что образующийся при этом хелат будет хуже растворим в воде по сравнению с хелатным лигандом. Хелаты с периферийными гидрофильными группами сольватируются полярными органическими растворителями (спиртами, кетонами, эфирами) и хорошо в них растворяются. Гидрофильные группы ( - О - Н .....О - ) обусловливают довольно высокую растворимость хелатов в неполярных растворителях.
Гидрофобные группы (не любят воду, слабо с ней взаимодействуют) - это все алициклические ( алифатические ) и ароматические группы. Хелатные соединения, в которых не все координационные места металла заняты активными группами хелатообразующего реагента, для заполнения координационной сферы образуют связи с полярными молекулами растворителя. Типичным примером может служить октаэдрические оксихинолинаты двухзарядных металлов, которые осаждаются из водных растворов в виде дигидратов [M(OX)2(H2O)2] с координационно связанной водой. Очевидно, из-за экранирующего влияния объемистых гидрофобных (ароматических групп) заместителей, наличие гидратной воды в молекуле хелата недостаточно, чтобы хелат стал растворим в воде. Это хелат с аквалигандом. И из-за наличия полярных групп плохо растворим и в неполярных растворителях. краска хелатовОкраска хелатов зависит от наличия групп - носителей цвета - хромофорных групп : = С = С =, =C=O, =C=S, =C=N-, -N=N-, -N=O, =C-C=C- .К хромофорным группам относятся также группы атомов с тройной связью, однако она не имеет значения в химии хелатов. Группы -усилители цвета - ауксохромные группы ( -CH3,-OH, -NH2, -O- , -NHC6H5).Во всех интенсивно окрашенных хелатах и в большинстве хелатообразующих реагентах имеется сопряженная 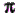 - система, в которой
- система, в которой 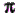 - электроны делокализованы и не принадлежат более какой-либо одной связи.
- электроны делокализованы и не принадлежат более какой-либо одной связи.
