Дослідження на граничний вміст домішок
В розділі ДФУ „Випробування на граничний вміст домішок” наводяться методи контролю неспецифічних домішок, в основному неорганічних катіонів та аніонів.
Випробування на хлориди СІ‾
Хлориди визначають за реакцією з розчином аргентуму нітрату у присутності кислоти нітратної розведеної:
CI¯ + AgNO3 → AgCI↓ + NO3¯
Опалесценція випробуваного розчину не має перевищувати опалесценцію еталона.
Випробування на сульфати SO42‾
Сульфати визначають за реакцією з розчином барію хлориду у присутності кислоти оцтової та еталонного розчину сульфату спиртового:
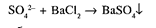
Опалесценція випробуваного розчину не має перевищувати опалесценцію еталона/
Випробування на солі амонію NH4+
Амонію солі:
Домішку визначають за допомогою лужного розчину калію тетрайодмеркурату (реактив Несслера):
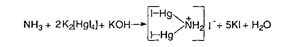
Через 5 хв. жовте забарвлення випробовуваного розчину має бути не інтенсивнішим за забарвлення еталона.
Випробування на солі кальцію Ca2+
Кальцій визначають за реакцією з розчином амонію оксалату в оцтовокислому середовищі в присутності еталонного розчину кальцію спиртового:
Ca2+ + (NH4)2C2O4 → CaC2O4↓ + 2NH4+
Опалесценція випробуваного розчину не повинна перевищувати опалесценцію еталону.
Випробування на солі важких металів
Важкі метали. Визначення домішки важких металів проводять взаємодією з тіоацетамідним реактивом:
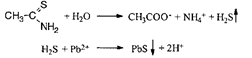
Коричневе забарвлення випробовуваного розчину не має бути інтенсивнішим за забарвлення еталона.
Випробування на арсен
Арсен. (метод Б) – базується на відновленні сполук арсену натрію гіпофосфітом NaH2PO2 у присутності кислоти хлористоводневої конц. та калію йодиду до металевого арсену:
NaH2PO2 + HCI → NaCI + H3PO2
As2O3 + 3H3PO2 → 2As↓ + 3H3PO3
As2O5 + 5H3PO2 → 2As↓ + 5H3PO3
Після нагрівання на водяній бані забарвлення має бути не інтенсивнішим за забарвлення еталона.
Випробування на солі магнію Mg2+
Магній .Визначення проводять у лужному середовищі взаємодією з розчином гідроксихіноліну в хлороформі:
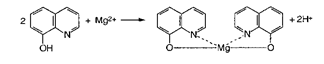
Жовто-зелене забарвлення органічного шару не повинно перевищувати забарвлення еталону.
Випробування на солі калію К+
Калій. Для визначення домішки калію використовують свіжоприготовлений розчин натрію тетрафенілборату – біла опалесценція випробуваного розчину не має перевищувати опалесценцію еталона.
K+ + NaB(C6H5)4 → KB(C6H5)4↓ + Na+
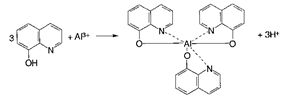
Випробування на солі алюмінію АІ3+
Алюміній. Визачення домішки алюмінію у лікарських речовинах проводять з розчином гідроксихіноліну в хлороформі – інтенсивність флуоресценції випробовуваного розчину має не перевищувати флуоресценцію еталона:
2.Фізико-хімічні способи визначення домішок- визначення прозорості, кольоровості, рН середовища , спектрофотометрія, хроматографія та інші.
Наявність домішок найчастіше викликає зміну забарвлення розчинів лікарських речовин або розчинності у воді та інших розчинниках. Тому критеріями чистоти є колір та /або прозорість рідин.
Визначення прозорості та ступеня каламутності рідин.
Прозорість та ступінь каламутності рідин визначають порівнянням з розчинником або еталоном. Спостереження проводять у розсіяному денному світлі через 5 хвилин після приготування еталона вздовж вертикальної осі пробірок на чорному фоні. Рідину вважають прозорою, якщо вона витримує порівняння з водою або розчинником, використаним для приготування рідини, або її каламутність не перевищує каламутність еталону 1.
Еталонів каламутності - 4.
Визначенні ступеня забарвлення рідин.
Визначення ступеня забарвлення рідин проводять візуально шляхом порівняння з відповідними еталонами. Забарвлення дослідного зразка за інтенсивністю не повинне перевищувати забарвлення еталона. Розчин вважають безбарвним, якщо він забарвлений не інтенсивніше, ніж вода, або еталон В9. Визначення ступеня забарвлення проводять на білому фоні.
Визначення рH середовища.
Невідповідність лікарської речовини за цим показникам може бути наслідком присутності домішок більш кислотного або основного характеру. Контроль може здійснюватися :
за зміною забарвлення кислотно - основних індикаторів (індикаторний метод);
інструментальним методом - потенціометричним визначенням (електрохімічний метод), заснованим на вимірюванні електрорушійної сили електродної пари і визначенні рН розчину, тобто негативного логарифму концентрації іонів водню.
Визначення рН є обов`язковим, наприклад, для всіх ін`єкційних розчинів , оскільки значення рН цих розчинів повинно наближатися до рН сиворотки крові, щоб вони не чинили подразнюючу дію.
Визначення рН ін`єкційних розчинів проводять за допомогою методу потенціометрії.
Література:
1. Ніжник Г.П. Фармацевтична хімія: підручник. - К.: ВСВ «Медицина», 2010. 352 с.
2. Фармацевтична хімія. За заг. ред. Проф. Безуглого П.О.- Вінниця, НОВА КНИГА,2006.- 552с.
3. Безуглий П.О., Грудько В.О., Леонова С.Г. та ін. Фармацевтичний аналіз. - X.: НФАУ,
2001. -240 с.
4. Беликов В.Г. Фармацевтическая химия - М.: Высш. пік., 1985. - 768 с.
5. Мелентьева Г.А., Антонова Л.А. Фармацевтическая химия. - М. : Медицина, 1985. - 480 с.
6. Прокопенко Т. С., Проценко Р. О. Фармацевтична хімія: Навч. посібник.- X.: Вид-во НФАУ,
2002. 142 с.
7. Державна Фармакопея України.-Іе вид.-РІРЕГ, 2001. - 556 с.
Питання для самопідготовки:
1 Джерела та причини забруднення лікарських засобів.
2. Фактори нестабільності лікарських засобів.
3. Процеси, що відбуваються при зберіганні лікарських засобів.
4. Ознаки і причини нестабільності.
5. Класифікація домішок.
6. Способи визначення домішок.
7. Загальні положення, яких необхідно дотримуватися при визначенні домішок (проведення випробувань на чистоту.
