Вимірювання та їх роль в теорії пізнання
Державна система вимірювань. Міжнародні метрологічні організації. Метрологія і її значення в науково-технічному прогресі. Фізична величина і її кількісна характеристика. Системи одиниць фізичних величин.
Види і методи вимірювань
Характеристика засобів вимірювань. Нормовані метрологічні характеристики засобів вимірювання. Різновидності похибок. Загальні методи оцінки похибок. Методи сумування складових похибки. Аналіз динамічних похибок засобів вимірювання.
Зміст і етапи обробки даних при вимірюванні
Традиційні статистичні методи обробки даних. Робасні методи обробки даних. Непараметричні методи обробки даних. Оцінка параметрів випадкових процесів.
Прямі вимірювання з однократними спостереженнями. Прямі вимірювання з багатократними спостереженнями. Опосередковані вимірювання з однократними спостереженнями. Опосередковані вимірювання з багатократними спостереженнями.
Постановка задачі при обробці даних спостережень сумісних і сукупних вимірювань. Метод найменших квадратів. Методика обробки результатів сукупних і сумісних вимірювань.
Показники точності засобів вимірювання. Причини похибок засобів вимірювання.
Методи розрахунку статичних похибок засобів вимірювання. Диференційний метод розрахунку похибок. Оцінка похибки засобів вимірювання за структурною схемою. Ймовірнісний метод розрахунку похибок.
Короткі теоретичні відомості
Фізичні методи аналізу
Визначення густини
1. Визначення густини рідин за допомогою пікнометра при 200С:
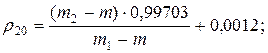
де m – маса порожнього пікнометра, m1 – маса пікнометра з дистильованою водою, m2 – маса пікнометра з досліджуваною рідиною.
2. Визначення густини твердих речовин за допомогою пікнометра при 200С:
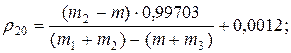
де: m – маса порожнього пікнометра, m1 – маса пікнометра з дистильованою водою, m2 – маса пікнометра з досліджуваною речовиною, m3 – маса пікнометра з твердою речовиною і водою.
Визначення в’язкості.
3. Визначення в’язкості рідин капілярним методом:
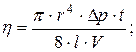
де: r – радіус капіляра, l – його довжина, ∆p – різниця тисків на кінцях капіляра, V – об’єм рідини, що витікає за час t.
4. Визначення відносної в’язкості рідин капілярним віскозиметром Освальда:
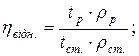
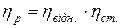 ;
;
де: ηвід. – відносна в’язкість, ηр – в’язкість досліджуваної рідини, ηст. - в’язкість рідини стандарту, ρр – густина досліджуваної рідини, ρст.- густина рідини стандарту, tр – час витікання рідини, tст. – час витікання рідини стандарту.
5. Визначення в’язкості рідин методом падаючої кульки (метод Стокса):
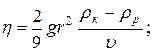
де: r – радіус кульки, ρк і ρр – густина кульки і досліджуваної рідини, υ – швидкість руху кульки в рідині.
6. Визначення відносної в’язкості рідин віскозиметром Гепплера з падаючою кулькою:
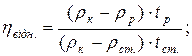
де: ρк – густина кульки, ρр - густина досліджуваної рідини, ρст. – густина рідини стандарту, tст. – час падіння кульки в рідині стандарту, tр - час падіння кульки в досліджуваній рідині.
Хроматографія
7. Визначення часу затримки елюювання:
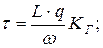
де: L – довжина хроматографічної колонки, ω – об’ємна швидкість елюювання, КГ – константа Генрі, q – функціональна константа колонки.
8. Визначення константи розділення речовин А і В:
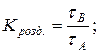
9. Визначення ступеня розділення речовин А і В:
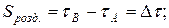
де: τА і τВ час затримки речовини А і В.
Седиментація
10. Визначення швидкісті осідання частинок:
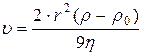 ;
;
11. Визначення константи седиментації:
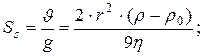
де: r - радіус дисперсійної частинки, ρ - густина дисперсійної частинки, ρ0 і η - густина і в’язкість дисперсійного середовища, g - прискорення вільного падіння.
Центрифугування
12. Визначення швидкості осідання частинок при центрифугуванні:
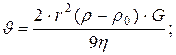
де: r - радіус дисперсійної частинки, ρ - густина дисперсійної частинки, ρ0 і η - густина і в’язкість дисперсійного середовища, G - відцентрове прискорення.
13. Визначення часу центрифугування:
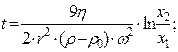
де: r - радіус дисперсійної частинки, ρ - густина дисперсійної частинки, ρ0 і η - густина і в’язкість дисперсійного середовища, ω2 – кутова швидкість обертання ротора центрифуги. Рівняння дає можливість обчислити час центрифугування t, який необхідний щоб частинка радіусом r і густиною r осіла в центрифужній пробірці на відстань Dx = x2 – x1.
Фотометрія
14. Закони поглинання світла розчинами речовин, закон Бугера:
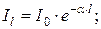
де: I0 - інтенсивність світла, що падає на шар речовини в кюветі, Il - інтенсивність світла, що виходить з кювети, l – товщина кювети, 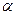 - натуральний показник поглинання.
- натуральний показник поглинання.
15. Закон Бугера - Ламберта – Бера:
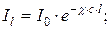
де: I0 - інтенсивність світла, що падає на шар речовини в кюветі, Il - інтенсивність світла, що виходить з кювети, l – товщина кювети, 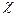 – молярний показник поглинання, с – молярна концентрація розчину.
– молярний показник поглинання, с – молярна концентрація розчину.
Показники фотометрії
16. Коефіцієнт пропускання:
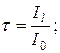
17. Оптична густина розчину:
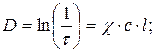
18. Визначення концентрації методом стандартних розчинів:
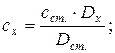
де: сх і сст. – концентрації досліджуваного і стандартного розчинів, Dx і Dст. – оптичні густини досліджуваного і стандартного розчинів.
19. Визначення концентрації методом стандартних добавок:
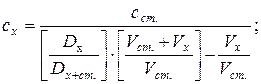
де: сх і сст. – концентрації досліджуваного і стандартного розчинів, Dx - оптична густина досліджуваного розчину, Dx+ст. – оптична густина досліджуваного розчину після додавання до нього стандартного розчину, Vx і Vст. – об’єми досліджуваного і стандартного розчинів.
Нефелометрія
20. Рівняння Релєя:
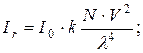
де: I0 – інтенсивність падаючого світла, Ir – інтенсивність розсіяного світла, N – кількість частинок в кюветі, V – об’єм частинки, λ – довжина хвилі падаючого світла, k – константа приладу.
21. Визначення концентрації частинок методом стандартних розчинів при однаковому їх об’ємі (V = const):
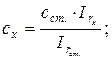
де: сх і сст. - концентрації досліджуваного і стандартного розчинів, 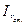 і
і 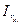 - інтенсивності розсіювання світла досліджуваним і стандартним розчинами.
- інтенсивності розсіювання світла досліджуваним і стандартним розчинами.
22. Визначення об’єму частинок методом стандартних розчинів при їх однаковій концентрації (с = const):
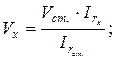
де: Vх і Vст. – об’єми частинок в досліджуваному і стандартному розчинах, 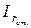 і
і 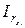 - інтенсивності розсіювання світла досліджуваним і стандартним розчинами.
- інтенсивності розсіювання світла досліджуваним і стандартним розчинами.
Рефрактометрія
23. Визначення концентрації речовини в розчині за показником заломлення світла:
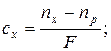
де: cx – процентна концентрація розчину, nx і np – показник заломлення розчину і чистого розчинника, F – фактор приросту, який визначається експерементально.
24. Визначення молекулярної рефракції:
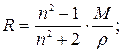
де: n – показник заломлення, М – молекулярна маса речовини, ρ – густина речовини.
Поляриметрія
25. Визначення концентрації речовини в розчині за кутом обертання площини поляризації світла:
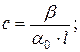
де: α 0– питоме обертання площини поляризації, β –кут обертання площини поляризації розчином, l – товщина шару розчину в кюветі.
26. Визначення концентрації методом стандартних розчинів:
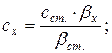
де: сх і сст. – концентрації досліджуваного і стандартного розчинів, βx і βст. – кути обертання площини поляризації в досліджуваному і стандартному розчинах.
Потенціометрія
27. Рівняння Нернста для електродного потенціалу:
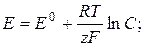
де: Е – електродний потенціал; Е0 - нормальний потенціал металу; R – газова стала; Т – абсолютна температура; z – заряд іону; F – число Фарадея; С – концентрація іонів металу в розчині.
28. Рівняння Нернста для окисно-відновного потенціалу:
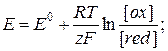
де: Е - електродний окисно-відновний потенціал; Е0 - нормальний окисно-відновний потенціал; z – число електронів, які беруть участь в реакції; [ox] – концентрація окисленої форми іону; [red] - концентрація відновленої форми іону.
29. Значення рН, рОН та звязок між ними:
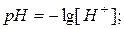
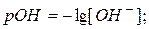 рОН = 14 – рН;
рОН = 14 – рН;
де: [H+] і [OH-] – молярні концентрації іонів.
30. Зв’язок між концентрацією іону і концентрацією електроліту:
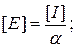
де: [I] – концентрація електроліту, [Е] – концентрація іону, α – ступінь дисоціації електроліту.
31. Визначення концентрації розчину за методом титрування:
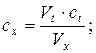
де: cx і ct - концентрації досліджуваного розчину і титрату, Vx і Vt – об’єми досліджуваного розчину і титрату.
Полярографія
32. Рівняння Ільковича для ртутного електроду:
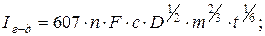
де: Іг-д – величина граничного дифузійного струму, n – заряд іона; F – число Фарадея; с – концентрація іону в розчині; D – коефіцієнт дифузії; m – маса ртуті; t – час витікання ртуті масою m.
33. Визначення концентрації методом стандартних розчинів:
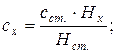
де: сх і сст. – концентрації досліджуваного і стандартного розчинів, Hx і Hст. – величини полярографічних півхвиль досліджуваного і стандартного розчинів.
34. Визначення концентрації методом стандартних добавок:
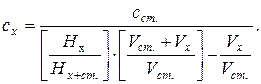
де: сх і сст. – концентрації досліджуваного і стандартного розчинів, Hx – величина півхвилі досліджуваного розчину, Hx+ст. – величина півхвилі досліджуваного розчину після додавання до нього стандартного розчину, Vx і Vст. – об’єми досліджуваного і стандартного розчинів.
Метрологія
