Анализ смеси катионов V группы
Реакции катиона Fe2+
Растворы солей двухвалентного железа окрашены в бледно-зеленый цвет, разбавленные растворы бесцветны.
Гексациано-(III)-феррат калия K3[Fe(CN)6] дает с катионом Fe2+ синий осадок турнбулевой сини:
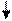
 3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3K2SO4
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3K2SO4
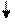
 3Fe2+ + 2[Fe(CN)6]3- = Fe[Fe(CN)6]2
3Fe2+ + 2[Fe(CN)6]3- = Fe[Fe(CN)6]2
Выполнение опыта
Налейте 2-3 капли раствора сульфата железа (II), добавьте 4-5 капель дистиллированной воды и 2 капли гексациано-(III)-феррата калия. Обратите внимание на цвет осадка. Проверьте растворимость его в кислотах и щелочах.
Вывод:
Реакции катиона Fe3+
Растворы солей трехвалентного железа имеют желтую или красно-бурую окраску.
Гексациано-(II)-феррат калия K4[Fe(CN)6] образует с катионом Fe3+ темно-синий осадок берлинской лазури:
4FeСl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3↓ + 12KCl
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3↓
Выполнение опыта
Возьмем в пробирку 2-3 капли раствора хлорида железа (III), добавьте 3-4 капель дистиллированной воды, 1-2 капли соляной кислоты и 2 капли гексациано-(II)-феррата калия. Проверьте растворимость полученного осадка в сильных кислотах и в избытке реактива.
Вывод:
Реакции катионы Mn2+
Растворы солей марганца имеют бледно-розовую окраску, а разбавленные растворы бесцветны.
а) Окисление диоксидом свинца идет по уравнению.
2Mn(NO3)2 + 5PbO2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
 2 Mn2+ + 4H2O - 5ē → MnO
2 Mn2+ + 4H2O - 5ē → MnO 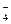 + 8H+
+ 8H+
5 PbO2 + 4H+ +2ē → Pb2+ + 2H2O
 2Mn2+ + 8H2O + 5PbO2 +20H+ = 2MnO
2Mn2+ + 8H2O + 5PbO2 +20H+ = 2MnO 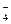 + 16H+ + 5Pb2+ + 10H2O
+ 16H+ + 5Pb2+ + 10H2O
2Mn2+ + 5PbO2 + 4H+ = 2MnO 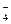 + 5Pb2+ + 2H2O
+ 5Pb2+ + 2H2O
Выполнение опыта
Налейте в пробирку 1-2 капли нитрата или сульфата марганца (но не хлорида, почему?), прилейте 5 капель разбавленной (1:1) азотной кислоты и добавьте на лопатке немного диоксида свинца PbO2 и нагрейте смесь до кипения. Прилейте 1-2 мл дистиллированной воды и, не перемешивая содержимое пробирки, дайте немного постоять. Что наблюдаете?
Вывод:
Шестая группа катионов Cu2+, Cd2+, Hg2+, Co2+, Ni2+
Реакции катиона Cu2+
Растворы солей имеют голубую или зеленую окраску.
1. Гексациано-(II)-феррат калияK4[Fe(CN)6] при рН≤7 образует с ионом Cu2+ красно-бурый осадок.
2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4
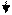
 2Cu2+ + . . . → . . .
2Cu2+ + . . . → . . .
Выполнение опыта
В пробирку налейте 5-6 капли раствора CuSO4, подкислите 2-3 каплями уксусной кислоты и добавьте 4-5 капель гексациано-(II)-феррата калия. Если в растворе очень мало меди, то раствор окрашивается в розовый цвет.
Вывод:
Реакции катиона Со2+
В водных растворах соли кобальта (II) имеют розово-фиолетовую окраску.
1. Роданид аммония (или калия) NH4SCN (KSCN) образует с катионом Со2+ комплексную соль
СоCl2 + 4NH4SCN = (NH4)2 [Co(SCN)4] + 2NH4Cl
Co2+ + . . . → . . .
Тетрароданокобальтиат аммония имеет красивую сине-голубую окраску; ион [Co(SCN)4]2- неустойчив и легко распадается в водных растворах, но более устойчив в органических растворителях (амиловый спирт, ацетон, этиловый спирт).
Выполнение опыта
В пробирку поместите несколько кристалликов CoSO4, добавьте 8-10 капель насыщенного р-ра NH4SCN. Образуется комплексное соединение (NH4)2[Co(SCN)4] ярко-синего цвета. Прилейте несколько капель дистиллированной воды – раствор приобретает розовый цверт, характерный для солей двухвалентного кобальта. При добавлении нескольких капель ацетона или этилового спирта раствор вновь становится ярко-синего цвета.
Вывод:
Количественный анализ
