Тұнбалардың пайда болуы және олардың қасиеттері
Тұнбалардың пайда болуы әлі аяғына дейін шешілмеген, күрделі физика- химиялық процесс. Тұнбаның қасиеті көбінесе тұнбаның пайда болу механизмінің ішіндегі екі сатымен анықталады. Ол: 1) кристалдану орталығының (кристалдардың ұрығы) пайда болуы; 2) пайда болған ұрықтардың әрмен қарай өсуі. Жаңа пайда болған бөлшектердің мөлшері осы екі сатының қайсысы басым болуына байланысты. Кристалдану орталығының пайда болуы ең аз мөлшердегі иондар не молекулалардың бірігіп тұрақты екінші фаза түзу процесі. Мысалы, күміс хроматының ұрығы 6 , барий сульфатының ұрығы 8 иондардан тұрады. Тұнбаның әрмен қарай тұнуы не жаңа орталықтардың пайда болуы, не алғашқы ұрықтардың әрмен қарай өсуі жолымен жүреді. Егер тұну бірінші жолмен жүрсе тұнба көп мөлшерде өте ұсақ бөлшектерден тұрады, егер екінші жол басым болса, онда ірі кристалды тұнба алынады.
Сапалық түрде қандай тұнба түсетіні ерітіндінің қаншалықты аса қаныққандығына байланысты. Оны салыстырмалы асақанығу (САҚ) дейтін мәнмен сипаттауға болады:
САҚ= 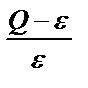
Q – тұндырар алдындағы араластырылатын реагенттердің молярлі концентрациясы, Q = C/2;
ε – тепе – теңдік орнағаннан кейінгі тұнбаның молярлі ерігіштігі.
Нашар еритін тұнба түсу процесінде тұнба түсіргіштің қосылған әр үлесі ерітіндінің аса қанығуына әкеп соғады, яғни Q > ε. Біраздан кейін бұл тұрақсыздық жағдай бұзылып тұнба пайда болады. Тәжірибелік байқаудан пайда болған тұнба бөлшектерінің мөлшері реагенттің әр үлесін құйғандағы салыстырмалы аса қанығу мәніне кері пропорционалды. Егер тұнба аз ерісе (ε мәні аз) және концентрлі ерітінділерден (Q үлкен ) түсірілсе, онда 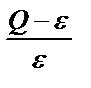 үлкен мән. Бұл ерітіндіде көп мөлшерде алғашқы кристалдардың түсуіне, соған сәйкес ұсақ бөлшекті аморфты тұнба түзілуіне себеп болады. Егер
үлкен мән. Бұл ерітіндіде көп мөлшерде алғашқы кристалдардың түсуіне, соған сәйкес ұсақ бөлшекті аморфты тұнба түзілуіне себеп болады. Егер 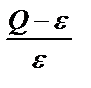 аз болса ( Q мөлшері аз, ε үлкен), онда кристалдану орталығы аз пайда болады да, пайда болған орталықтардың әрмен қарай өсу процесі басым болады, сондықтан ірі кристалды тұнба алынады.
аз болса ( Q мөлшері аз, ε үлкен), онда кристалдану орталығы аз пайда болады да, пайда болған орталықтардың әрмен қарай өсу процесі басым болады, сондықтан ірі кристалды тұнба алынады.
Кристалды тұнбалар
Кристалды тұнбаларды мүмкіндігінше ірі кристалды түрінде алынғаны жөн. Мұндай тұнбалар тез тұнады, сондықтан оларды ерітіндіден сүзіп бөліп алу жеңіл болады, сонымен қатар беткі қабаты кіші болғандықтан олар ерітіндіден бөгде иондарды аз адсорбциялайды.
Жоғарыда келтірілгендей, ірі кристалды тұнба алу үшін тұнбаның пайда болу жағдайында салыстырмалы аса қанығу мәні мүмкіндігінше аз болуы керек.
(Q-ε)/ε формуласынан тұнбаның ерігіштігі неғұрлым жоғары болса және тұнба түзетін реактивтердің концентрациялары неғұрлым аз болса, соғұрлым салыстырмалы аса қанығу мәні аз, соған сәйкес алғашқы кристалдар аз пайда болады да, кристалдар ірі болып түседі. Сондықтан ірі кристалды тұнба алу үшін тұндыру процесінде тұнбаның ерігіштігін арттыру және раективтердің концентрациясын азайту қажет. Тұнба түзілуде реакцияласатын иондардың концентрациясын азайтудың (Q-ды азайту) бірнеше жолы бар. Оның ең қарапайымы: 1) тұнба түсірер алдында ерітінділерді сұйылту; 2) тұнбаға түсіргішті тамшылап қосу; 3) ерітіндіні үнемі араластыру. Сұйытылған ерітінділерді пайдалану және араластырып ептеп тұндыру бір жерде пайда болатын аса қанығуды, соған сәйкес тұнбаның біркелкі түспеуін түгел жоя алмайды. Сондықтан, тұнба түсіргіштің концентрациясын азайтудың және оны біркелкі, үздіксіз, баяу алудың бір тиімді жолы – «пайда болатын реагент» әдісін пайдалану (гомогенді тұндыру). Бұл әдісте ерітіндіге тікелей тұнба түсіргіш құйылмай, оның орнына ерітіндіде баяу жүретін реакция нәтижесінде тұнба түсіргіш беретін зат қосылады. Тұнба түсіргіш ион зерттейтін ерітіндіде ептеп аз мөлшерде пайда болады, бұл салыстырмалы аса қанығу мәнін азайтуға мүмкіндік береді. Мысалы, барий ионын BaSO4 түрінде тікелей күкірт қышқылын құйып тұндырудың орнына диметилсульфат, не сульфаамин қышқылын қосып тұндыруға болады. Бұл жағдайда тұнбаға түсіргіш ерітіндіде жүретін протолитикалық реакцияның нәтижесінде алынады:
(CH3)2SO4 + 4H2O ↔ 2H3O+ + SO42- + 2CH3OH
HSO3NH2 + 2H2O ↔ H3O+ + SO42- + NH4+
Тұнбаға түсіргіштің ерітіндінің бар көлемінде біркелкі, үздіксіз аз жылдамдықпен пайда болуы бір жерде асақанығуды түгелдей жояды, сонымен қатар жүйедегі кристалдану орталығының санын азайтады, бұл ірі кристалды таза тұнба алуға мүмкіншілік береді.
Көптеген қышқылды ортада еритін гидроксидтерді, не әлсіз қышқылдардың тұздарын (карбонаттар, оксалаттар, кейбір сульфидтер т.б.) гомогенді ерітіндіден тұндыру ыңғайлы. Бұл жағдайда тұндыратын зат пен тұнбаға түсіргішті қышқыл ортада араластырады. Қышқыл ортада тұнба түзілмейді. Содан кейін ерітіндіге жүйедегі протондарды байланыстыратын зат қосылады. Нәтижесінде ерітіндінің бар көлемінде қышқылдық біркелкі, ептеп азаяды, бұл ірі кристалды тұнбалар алуға жағдай жасайды.
Мысалы, кальций иондарын қышқылда еритін оксалат түрінде тұндырады. Егер Са2+ және C2O42- иондарын қышқыл ортада араластырса тұнба түзілмейді. Енді осы ерітіндіге карбамид құйып қыздырса, мынадай реакция жүреді:
CO(NH2)2 + H2O ↔ 2NH3 + CO2
Реакцияның нәтижесінде баяу бөлінетін аммиак ептеп ерітіндінің қышқылдығын азайтып, CaC2O4 тұнбасының пайда болуына мүмкіншілік береді. Пайда болған кристалдар өте ірі және таза болады. Карбамидті осы жолмен Fe3+ және Al3+ иондарының жеңіл сүзілетін, таза гидроксидтерін тұндыруға пайдалануға болады. Кристалды тұнба түзілуге тұнбаның ерігіштігін арттыру да (ε-ні жоғарылату) көмектеседі. Тұнбаның ерігіштігі ерітіндіні қыздырғанда, оны сұйылтқанда және қышқылдығын көбейткенде артады. Тұнба түсіп болғаннан кейін оның ерігіштігін азайту керек, әйтпесе тұндыру толық болмауы мүмкін. Мысалы, BaSO4- тұнбасының ерігіштігін арттыру үшін оны ыстық ерітінділерден және HCl қатысында тұндырады. Тұндырудың аяғанда ерітіндіні суытып және тұнбаға түсіргіштің сәл артық мөлшерін құйып, BaSO4-тің ерігіштігін тағы азайтады.
Сонымен кристалды тұнбаны тұндырудың мынадай ережелерін тұжырымдауға болады:
1) тұндыруды сұйытылған ерітіндіден жүргізу;
2) тұнбаға түсіргішті ептеп, тамшылап қосу;
3) бір жерде асақанығуды болдырмау үшін тұнбатүзгіштің ерітіндісін үздіксіз араластырылатын ерітіндіге қосу керек;
4) тұндыруды ыстық ерітінділерден жүргізу керек;
5) тұнбаның ерігіштігін арттыратын зат қосу керек;
6) тұнбаны үстіндегі ерітіндімен бірге бірнеше сағатқа «жетілдіруге» (ескіруге) қалдыру.
Келтірілген жағдайларды қаншалықты сақтағанмен кейде ірі кристалдармен қатар өте ұсақ кристалдардың біраз мөлшері түзілуі мүмкін. Сондықтан қайтымсыз құрылымдық өзгерістер жүруі үшін тұнбаны үстіндегі ерітіндісімен бірнеше уақытқа қалдырады, яғни тұнбаны «ескіруге» қалдырады. Бұл жағдайда кристалдарды ірілендіретін және әбден жетілдіретін процестер жүреді.
Кристалдардың ірілену себебі – бірдей жағдайда ұсақ кристалдардың ерігіштігінің ірі кристалдардың ерігіштігінен басым болғанында. Мысалы, тәжрибелік жолмен BaSO4-тің ұсақ кристалдарының ерігіштігі (диаметрі 0,04 мк) бірдей температурада ірі кристалдардың ерігіштігінен 1000 еседей басым екені анықталған. Ұсақ кристалдардың еруі ірі кристалдардың әрмен қарай өсуіне себеп болады, яғни рекристаллизациялану процесі жүреді. Бұл процестің механизмін былай көрсетуге болады: ірі кристалдардың ерігіштігінің аз болуына байланысты осы кристалдармен салыстырғанда қаныққан ерітінді ұсақ кристалдар тұрғысынан қанықпаған болып есептеледі де, бұл кристалдарды ерітеді. Осының нәтижесінде ерітінді ірі кристалдар үшін асақаныққан болады, сондықтан еріген зат олардың бетіне қонады. Бұл процесс ұсақ кристалдар еріп, ірі кристалдарға түгел ауысқанша жүреді. Бұл процестің жылдамдығы комнаталық температурада төмен, ал ерітіндіні қыздырса оның жылдамдығы артады. Тұнбаның «ескіруі» кристалдарды ірілетумен қатар, олардың тазаруына да себеп болады. Бұл ұсақ кристалдардың үздіксіз еріп қайтадан кристалдануына байланысты. Кристалдар ерігенде оларды ластайтын заттар да ерітіндіге ауысады, ал қайта кристалдар түзуге тек тұнбаның құрамындағы иондар ғана қатысады.
Аморфты тұнбалар
Егер тұнбаның ерігіштігі өте аз болса ерітінділерді аралыстырғанда лезде үлкен салыстырмалы асақанығу пайда болуын ((Q-ε)/ε – үлкен мән) жою мүмкін емес. Сондықтан кристалдану орталығының түзілу процесі басым болып, тұнба өте ұсақ, жиі коллоидты түрде пайда болады. Мысалы, аналитикалық жағдайда темір (ІІІ), хром (ІІІ), алюминий гидроксидтері және көптеген ауыр металдардың сульфидтері олардың ерігіштігі төмен болғандықтан тек коллоидты түрде бөлінеді.
Жиі пайда болған нашар еритін ұсақ бөлшектер ұзақ уақыт коллоидты ерітінді тұзіп тұнбаға бөлінбеуі мүмкін. Коллоидты бөлшектердің бір-бірімен қосылмай ерітіндіде жүруінің бір себебі – ол бөлшектердің аттас электрлік зарядпен зарядталғандығында. Зарядтарының әсерінен коллоидты бөлшектер бір-бірінен тебіседі, бұл тебісу олардың қосылып ірі агрегаттар түзуіне кедергі жасайды. Коллоидты бөлшектердің зарядталғанын ерітіндіден электрлік тоғын жіберіп білуге болады. Ток жібергенде көптеген коллоидты бөлшектер, мысалы сульфидтер анодқа қарай ығысады, демен бұл бөлшектер теріс зарядталған. Оң зарядталған бөлшектер катодқа қарай ығысады.
Коллоидты бөлшектердің зарядтары олардың ерітіндіден катиондарды не аниондарды адсорбциялауы нәтижесінде пайда болады. Жиі біртектес иондар адсорбцияланады, яғни нашар еритін бөлшектердің кристалдық торына кіретін иондар. Мысалы, металдардың сульфидтері S2-, HS- аниондарын адсорбциялауға бейімді, күміс галогенидтері галогенид иондарын не күміс иондарын адсорбциялайды. Мысалы, мышьяк (ІІІ)-тұзы ерітіндісіне күкіртті сутегін жіберсе нашар еритін құрамында As2S3 молекулалары бар жеке бөлшектер пайда болады, бұл бөлшектер ерітіндіден НS- аниондарының бөлшектерін адсорбциялайды, сондықтан олар теріс зарядталады. Мұндай теріс зарядталған бөлшектер ерітіндіден қарама-қарсы зарядталған иондардың тиісті мөлшерін тартады («қарама-қарсы иондар» nH+). Қарама-қарсы иондардың бір бөлігі (х) «диффузиялық қабат» құрып сұйық фазада қалады, ал қалған бөлігі (n-x) қатты бөлшекпен адсорбцияланады.
Сонымен, нашар еритін бөлшектердің адсорбциялық қабаты қарама-қарсы зарядталған иондардың екі қабатынан тұрады, сондықтан оны «қос электрлік қабат» деп атайды.
Коллоидты бөлшектің заряды адсорбциялық қабаттағы қарама-қарсы иондардың жалпы заряды алғашқы адсорбцияланған иондардың жалпы зарядын толық жоймағандықтан пайда болады. Коллоидты бөлшек диффузиялық қабатпен «мицелла» түзеді. Коллоидты бөлшекті схемалық түрде былай көрсетуге болады:
{[As2S3]m.nHS- (n-x) H+}X-x H+
ядро
зарядталған бөлшек
электрбейтарапты бөлшек (мицелла)
Сол сияқты ерітіндіде KI-нің азырақ артық мөлшері бар AgI коллоидты бөлшектерінің құрылымы: {[AgI]m.nI.(n-x).K+}X-.xK+. Егер AgI коллоиды AgNO3 артық мөлшері бар ерітіндіде пайда болса, онда оның құрамы {[AgI]m.nAg+.(n-x).NO3-}X+.xNO3‑. Соңғы екі мысалда ядроның химиялық құрамы және кристалдық құрылысы ([AgI]m) бірдей болғанымен бөлшектердің заряды әртүрлі. Бірінші жағдайда ерітіндіде артық мөлшерде жүрген I- иондары адсорбцияланады, екінші жағдайда – Ag+ иондары.
Коллоидты бөлшектерге адсорбцияланып, оларды зарядтайтын, соған сәйкес тұрақтылығын арттыратып заттар стабилизаторлар-тұрақтандырғыштар деп аталады. Келтірілген мысалдарда H2S, KI және AgNO3 стабилизаторлар ролін атқарады.
Коллоидты ерітінділердің тұрақтылығы зарядты бөлшектер пайда болуымен қатар коллоидты бөлшектердің сольватты (гидратты) қабат түзуіне де байланысты. Сольватация, не еріткіштің молекулаларының адсорбциялануы осы молекулалардың дипольдық моментімен анықталады. Нәтижесінде коллоидты бөлшектер сольватты қабаттармен қоршалады да, олар бөлшектердің бір-біріне жақындауына, соған байланысты ірі агрегаттар түзуіне мүмкіншілік бермейді. Коллоидты бөлшектердің сольвататану қабілеттігі әртүрлі, сондықтан олар лиофильді (еріткіштің молекулаларын жақсы адсорбциялайды) және лиофобты (еріткіштің молекулаларын адсорбцияламайды) коллоидтар болып екіге бөлінеді. Егер еріткіш су болса, олар гидрофильді және гидрофобты деп аталады.
Көптеген коллоидты жүйелердің бөлшектерін ірілету (коагуляция) онша қиын емес: Коллоидтардың коагуляциялану процесі бөлшектердің бір-бірінен тебісу күштерін азайтқанда жүреді. Ол үшін ерітіндіні қыздырып араластырады. Температураның жоғарылауы адсорбция құбылысын, соған сәйкес бөлшектердің жалпы зарядын төмендетеді. Сонымен қатар, бөлшектердің кинетикалық энергиясы артып, олардың жақындауына кедергі жасайтын күштерді жеңуге мүмкіншілік туады. Коагуляция процесін жүргізудің нәтижелі әдісі – ерітіндідегі күшті электролиттердің концентрациясын арттыру. Бұл жағдайда коллоидты бөлшектер электролиттің қарама-қарсы зарядталдған иондарын адсорбциялап өздерінің зарядтарын кемітеді де , олардың бір-бірімен қосылу мүмкіндігі пайда болады. Коллоидты ерітіндіні коагуляциялауға қажет электролиттің ең аз концентрациясын осы электролиттің коагуляцияландыру концентрациясы дейді. Оның мәні алдымен коллоидты бөлшектердің зарядының таңбасына (+ не -), сонымен қатар коагуляциялайтын электролиттің қарама-қарсы иондарының зарядына байланысты. As2S3 – пен тәжрибеде бір-, екі-, үшзарядталған иондардың коагуляцияландыру концентрациясы бір-біріне қатынасы орта мәнмен 500:10:1 сәйкес.
Коллоидты бөлшектердің алғашқы зарядын анықтайтын иондар олардың бетінде коагуляциялану кезінде де, одан кейін де қалады. Процесс коагуляцияланатын тұнбамен қарама-қарсы иондардың эквивалентті мөлшерінің адсорбциялауынан тұрады.
Коагуляцияланған тұнба аморфты тұнба деп аталады, бұл тұнба ұсақ бөлшектерден тұрғандықтан беткі қабаты үлкен болады. Егер белгілі жағдай жасаса сүзуге және жууға ыңғайлы, біршама таза аморфты тұнба алуға болады. Ол жағдайлар:
1) тұнбаны концентрленген ерітінділерден тұндыру;
2) тұнбаны ыстық ерітінділерден үнемі араластырып тұндыру;
3) тұнбаны электролит-коагулятор қатысында тұндыру;
4) тұнба түсісімен ерітіндіні сұйылтып, тікелей сүзу.
