Контрольные задачи к теме 1
Тема 1. Основные понятия и законы химии. Классы неорганических соединений.
Химияизучает состав, строение, свойства и превращения веществ, а так же явления, которые их сопровождают. При химических превращениях или химических реакциях из одних веществ получаются другие.
Веществосостоит из отдельных частиц – молекул, атомов или ионов, которые являются объектами изучения химии.
Стехиометрия(от греч. stoicheion – элемент,основание) – учение о количественных соотношениях между реагирующими веществами и между атомами в формулах различных веществ.
Атом– (от греч. atomos – неделимый) – наименьшая химическая частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Молекула(от лат. moles- масса) – наименьшая частица вещества, определяющая его состав и свойства.
В зависимости от состава вещества делятся на простые и сложные. Простые вещества образованы атомами одного химического элемента. Например цинк, металл Zn, азот – газ - N2, сера, неметалл S, олово, металл Sn, кислород – газ – О2, хлор – газ – Cl2 и т.д. Сложные вещества образованы атомами разных элементов.
Наиболее важные классы неорганических соединений: оксиды, гидроксиды, кислоты, соли.
Оксидами – называются соединения элементов с кислородом. По своим химическим свойствам они подразделяются на солеобразующие и несолеобразующие. В свою очередь солеобразующие оксиды делятся на основные, кислотные, амфотерные.
Основными называются те оксиды, которые при взаимодействии с кислотами или кислотными оксидами образуют соли. Например: СаО, Na2O и т.п.
Кислотными называются оксиды, которые при взаимодействии с гидроксидами или основными оксидами образуют соли. Например: SO2, CO2 и т.п.
Амфотерными называются оксиды, которые образуют соли как при взаимодействии с основными, так и кислотными оксидами. Так Al2O3 растворяется с образованием солей в кислотах и щелочах.
Гидроксидами (основаниями) называются сложные вещества диссоциирующие в растворах или расплавах с образованием гидроксильных анионов. Так к гидроксидам относятся NaOH, Ca(OH)2 и т.п. В зависимости от содержания гидроксильных ионов основания делятся на однокислотные (NaOH), двухкислотные (Са(ОН)2) и т.д.
Кислотами называются сложные вещества, диссоциирующие в водных растворах или расплавах с образованием катионов водорода. Например: HCl, H3PO4 и т. п. По своему составу кислоты могут быть разделены на кислородсодержащие (HNO3, H2SO4) и бескислородные (HCl, HCN).В зависимости от числа содержащихся в молекуле кислоты атомов водорода, способных замещаться атомами металла, различают кислоты одноосновные (HNO3,HCl), двухосновные (H2CO3, H2SO4), трехосновные (H3PO4), четырехосновные (H4P2O7) и т.д.
Соли могут рассматриваться как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или гидроксильных групп в молекуле основания кислотными остатками. При полном замещении атомов водорода или гидроксильных групп образуются средние (нормальные) соли, при неполном замещение атомов водорода образуются кислые соли (NaH2PO4; NaHCO3), при неполном замещении гидроксильных групп – основные соли ((CuOH)2CO3; Al(OH)2Cl). Кислые соли образуются многоосновными кислотами. Основные соли могут быть образованы только многокислотными основаниями.
Относительная молекулярная масса химического соединения (Мr) численно равна сумме относительных атомных масс (Аr) всех атомов, входящих в состав молекулы вещества.
Mr(H2O) = 2Ar(H) + Ar(O) = 2· 1 + 16 = 18
Моль – количество вещества (ν), содержащего столько же частиц (атомов, молекул или ионов), сколько атомов углерода содержится в 12г изотопа углерода 12С, т.е. 6,02·1023.
Молярная масса(М) – масса одного моля вещества. Численно совпадает с относительной молекулярной массой. Выражается в г/моль.
Мr(H2O) = 18 , следовательно М(Н2О) = 18 г/моль
Пример 1.Осуществить цепочку превращения веществ и указать название каждого соединения.
Na → NaOH → NaHSO4 → Na2SO4 → BaSO4
1. 2Na + 2 H2O = 2 NaOH + H2
гидроксид натрия водород
2. NaOH + H2SO4 = NaHSO4 + H2O
серная кислота гидросульфат натрия вода
3. NaHSO4 + NaOH = Na2SO4 + H2O
сульфат натрия
4. Na2SO4 + BaCl2 = 2 NaCl + BaSO4↓
хлорид натрия сульфат бария
Основные стехиометрические законы химии
1. Закон сохранения массы веществ (1748 г. М.В.Ломоносов)
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
2. Закон постоянства состава(1808 г. Пруст)
Всякое чистое вещество, независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
3. Закон кратных отношений (1803 г. Д. Дальтон)
Если два элемента образуют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым количествами другого элемента относятся между собой как небольшие целые числа.
4. Закон простых объёмных отношений (1808 г. Гей-Люссак)
Объёмы вступающих в реакцию газов при одинаковых условиях относятся друг к другу как стехиометрические коэффициенты (простые целые числа)
5. Закон Авогадро (1811 г. А.Авогадро)
В равных объёмах различных газов при одинаковых условиях (Р, Т) содержится одинаковое число молекул.
Следствие: Моль любого газа (при Р, Т = const) занимает один и тот же объём. 1 моль газа содержит 6,02 · 1023 молекул и занимает объём 22,4 дм3 при нормальных условиях (tо=0оС, То=273 К, Ро=101,3 кПа)
ν = 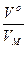
 ν=
ν= 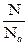
Пример 2.Вычислить массовую долю каждого элемента в молекуле карбоната кальция.
Решение: Формула соли – СаСО3, следовательно
М(СаСО3) = Аr(Са) + Аr(С) + 3·Аr(О) = 40 + 12 + 3· 16 = 100 г/моль
Массовую долю элемента в веществе рассчитываем по формуле:
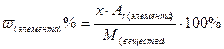
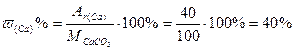 ;
; 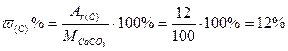
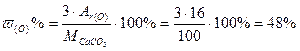
Пример 3.Какой объём углекислого газа образуется при сжигании 100 г угля содержащего 10% примесей.
Решение: Составляем уравнение химической реакции:
m(смеси) = 100г
ω(примесей) = 10% Vo-?
С + О2 = СО2
ν = 1моль ν = 1моль
М = 12 г/моль VM = 22,4 дм3
В 100 г смеси процентное содержание углерода равно 100% - 10% = 90%, что составляет в граммах 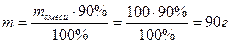 , отсюда
, отсюда 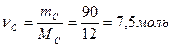 . По уравнению химической реакции
. По уравнению химической реакции 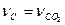 следовательно
следовательно 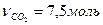 . Объём выделившегося газа будет равен
. Объём выделившегося газа будет равен 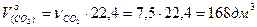
Контрольные задачи к теме 1
В задании необходимо:
1.Написать уравнения реакций, которые необходимо провести для осуществления следующих превращений и указать название каждого соединения.
2.Рассчитать массовую долю элемента ω(х)% в подчеркнутом соединении.
3.Выполнить расчет по уравнению химической реакции в указанном варианте задания, отмеченной одной звездочкой.
Vо=5,6л m(соли)-? ω (Н)-?
1. N2 → NH3 *→ (NH4)2SO4 → NH4OH → NH4Cl → AgCl
m(смеси) = 3 кг
m(примеси) = 5% m(соли) - ? ω (S)-?
2. Al → Al2O3 *→ AlCl3 → Al(OH)3 → Al2(SO4)3 → BaSO4
m (р-ра) = 20 г
ω (Са)-? С%(к-ты) = 10% m(соли) - ?
3. Р → Р2О5 → Са3(РО4)2 *→ Н3РО4 → (NH4)3PO4 → AlPO4
m(смеси) =0,8 кг
ω(примеси) = 15% m(Fe) -? ω (О) -?
4. Fe(OH)3 → Fe2O3 * → Fe → FeSO4 → Fe(OH)2 → FeCl2
ω(примесей)=2%
Vо(газа)=1,12 дм3 m(соли) - ? ω(Н)-?
5. Cl2 * → SiCl4 → Si → SiO2 → Na2SiO3 → H2SiO3
Vо(газа)=4,48 дм3 m(соли) - ? ω(Al)-?
6. СН4 → СО2 * → FeCO3 → FeO → Al2O3 → Na3[Al(OH)6]
m(соли)-?
ω(примесей)=5% m(оксида)=15,3 г ω(Ва)-?
7. BaS *→ BaO → Ba → Ba(OH)2 → BaJ2 → Ba3(PO4)2
Vр-р=100см3
ω(N)-? См=0,1 М Vо(газа)=?
8. HNO3 → NH4NO3→ NH4OH * → NH3 → N2 → NO2
m(смеси)= 1кг
ω(примесей)=2% Vо(газа)-? ω(О)-?
9. MgO → Mg → MgCl2 → MgCO3 *→ CO2 → KHCO3
m(смеси)=5кг
ω(примесей)=8% m(металла)-? ω(N)-?
10. NiO *→ Ni → NiSO4 → Ni(OH)2 → Ni(NO3)2 → NiCO3
Vо(газа)=4,48дм3 m(осадка)-? ω (Mn)-?
11. H2O2 → O2 → CO → CO2 *→ CaCO3 → Ca(MnO4)2
m(смеси)=?
ω(примесей)=10% m(соли)=15,8г ω(О)-?
12. Cr(OH)3 → Cr2O3 → Cr *→ CrCl3 → Cr(OH)3 → K3[Cr(OH)6]
Vр-р=150см3
ω(K)-? См= 3М m(осадка)-?
13. K → K2S → K2O → KOH → K2 CrO4 * → BaCrO4
m(смеси)=20г
ω(примесей)-? Vо(газа)=11,2дм3 ω (Na)-?
14. S *→ SO2 → SO3 → Na2SO4 → Na2S → H2S
m(смеси)=0,5кг
ω(примесей)=1,5% m(оксида)=? ω(Na)-?
15. Sn(OH)2 → SnSO4 → SnS → SnO → Sn → Na2[Sn(OH)4]
Vр-р=100см3
См=0,2 М m(осадка)-? ω (К)-?
16. Pb → PbCl2 → Pb(NO3)2 *→ Pb(OH)2 → PbO → K2PbO2
Vо газа=8,7 дм3
ω(примесей)=5% m (оксида)-? ω(O)-?
17. S → H2S *→ SO2 → H2SO3 → Na2SO3 → CuSO3
m(смеси)=8кг
ω(примесей)=4% ω(оксида)-? ω(Cu)-?
18. CuS *→ CuO → Cu → Cu(NO3)2 → Cu(OH)2 → (CuOH)2SO4
Vр-р-?
ω(H)-? См=0,1М m(осадка)=23,3г
19. Na2ZnO2 → Zn(OH)2 → ZnO → Zn → ZnSO4 *→ BaSO4
m(смеси)=86г
ω(N)-? ω(примесей)=6% m(оксида)-?
20. Sr → Sr(OH)2 → Sr(NO3)2 → SrSO3 *→ SrO → SrPbO2
mр-ра=200г
m(оксида)-? С%= 5% ω(S)-?
21. Rb2O * → RbCl → Rb → RbOH → Rb2SO4 → Rb2CO3
m(соли)=0,5кг Voгаза-? ω(N)-?
22. I2 → HI → NH4I *→ NH3 → NH4HCO3 → MnCO3
m(смеси)=2кг
ω(O)-? ω(примесей)=15% m(соли)-?
23. Ni(OH)2 → NiO *→ NiBr2 → NiS → H2S → NH4HS
mр-ра=150г
Voгаза-? С% = 6% ω(Ca)-?
24. F2 *→ KF → HF → H2O → Ca(OH)2→ CaHPO4
m(смеси)=50г
Voгаза-? ω(примесей)=7% ω(С)-?
25. C → CO2 *→ Ca(HCO3)2 → CaCO3 → CaO → Ca(OH)2
Тема 2. Строение атома
Атом – наименьшая частица химического элемента – носитель всех его химических свойств. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Ядро составляет основу атома и определяет индивидуальность элементов. В ядро атомов всех элементов (исключение H) входят протоны и нейтроны, которые могут взаимно превращаться друг в друга. Протон (р)-элементарная частица с массой покоя 1,00728 и положительным зарядом, по абсолютной величине равным заряду электрона. Число протонов в ядре характеризует его заряд и принадлежность атома данному химическому элементу. Нейтрон (n) также представляет собой элементарную частицу, но не обладающую электрическим зарядом; масса покоя нейтрона составляет 1,00867. Сумма числа протонов и числа нейтронов, содержащихся в ядре атома, называется массовым числом атома (ядра). Атомы, обладающие одинаковым зарядом ядра, но разным числом нейтронов, называют изотопами. Как правило, каждый элемент представляет собой совокупность нескольких изотопов. Именно этим объясняются значительные отклонения атомных масс многих элементов от целочисленных величин.
При всех химических процессах ядра атомов элементов, входящих в состав реагирующих веществ, не изменяются. Изменения при этом претерпевают только электронные оболочки. Химическая энергия, таким образом, связана с энергией электронов. Электрон ē – частица, обладающая элементарным отрицательным электрическим зарядом, равным 1,602-10-19 Кл. Масса покоя электрона составляет 1/1837 массы протона.
Электрону, как и любому микрообъекту, присуща двойственная корпускулярно-волновая природа. Движение электрона в атоме носит вероятностно-волновой характер. Околоядерное пространство, в котором с наибольшей вероятностью может находиться электрон, называется атомной орбиталью (АО). АО характеризуется тремя параметрами (координатами), получившими название квантовых чисел (п, l, ml). Они определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную АО, электрон образует электронное облако (электронную орбиталь). Электронное облако характеризуется четырьмя квантовыми числами (п, l, ml ,ms). Набором этих чисел можно полностью охарактеризовать состояние любого электрона в атоме.
n – главное (радиус орбитали и возможные энергетические состояния электронов, принимают значения от 1 до 7),
l - орбитальное (форма орбитали, значения от 0 до n-1):
| n | l | Орбиталь |
| 1 (K) | 1s | |
| 2 (L) | 0, 1 | 2s, 2p |
| 3 (M) | 0, 1, 2 | 3s, 3p, 3d |
| 4 (N) | 0, 1, 2, 3 | 4s, 4p, 4d, 4f |
ml - магнитное (ориентация эл. облака, значения от 0 до ±l):
| Подуровень | l | m | Число орбиталей |
| S | |||
| P | 1, 0, -1 | ||
| D | 2, 1, 0, -1, -2 | ||
| F | 3, 2, 1, 0, -1, -2, -3 |
ms - спиновое (вращение электрона вокруг оси, значения: ±1/2).
Размещение электронов в атомах определяется несколькими принципами и правилами:
1. Принцип Паули – в атоме не бывает 2-х электронов с одинаковым набором квантовых чисел: т.е. на одной квантовой ячейке могут находиться только 2 электрона с противоположными спинами; максимальное число электронов в подуровне составляет s2p6d10f14 и максимальное число электронов на уровне N=2n2.
2. Принцип наименьшей энергии. Правило Клечковского: с ростом атомного номера элемента электроны размещаются последовательно на орбиталях с возрастающей суммой (n+l), при одинаковых значениях этой суммы они заполняют подуровни с меньшим значением n. Согласно этому правилу электроны заполняют подуровни в следующем порядке:
1s2®2s2®2p6®3s2®3p6®4s2®3d10®4p6®5s2®5p6®6s2®5d1®5f14®…
3. Правило Хунда - для невозбужденного атома - электроны в пределах подуровня располагаются так, чтобы их максимальное спиновое число было максимальным.
Свойства элементов тесно связаны со строением их атомов. Открытие периодического закона гениальным русским ученым Д. И. Менделеевым (1869 г.) создало новую эпоху в химии, определив пути ее развития на много десятков лет вперед.
Периодическая повторяемость свойств элементов обусловлена периодическим повторением сходных электронных группировок атомов.
Например: все атомы элементов I главной подгруппы Н, Li, Na, К, Rb, Cs, Fr имеют на внешнем энергетическом уровне по одному s‑электрону; все атомы элементов II главной подгруппы Be, Mg, Ca, Sr, Ba, Ra — по два s-электрона (это — s-элементы); атомы элементов III главной подгруппы В, Al, Ga, In, Tl — два s-электрона и один р‑электрон; атомы элементов IV главной подгруппы С, Si, Ge, Sn, Pb— два s-электрона и два р-электрона. Соответственно элементы III - VIII главных подгрупп называются р-элементами и принадлежат к р-электронному семейству. Элементы побочных подгрупп принадлежат к d-электронному семейству. Элементы, следующие за лантаном (лантоноиды) и за актинием (актиноиды), принадлежат к f-электронному семейству.
Химическая природа элемента обусловливается способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации называют количество энергии, необходимое для отрыва электрона от невозбужденного атома. Сродством к электрону называют энергетический эффект процесса присоединения электрона к нейтральному атому с превращением его в отрицательно заряженный ион. Энергия ионизации служит мерой металлических и в первом приближении восстановительных свойств элементов. Энергия сродства к электрону является мерой неметаллических и косвенно окислительных свойств элементов. Наиболее полную характеристику металлических и неметаллических свойств элементов, а также способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения дает величина, называемая относительной электроотрицательностью (ОЭО). Согласно определению Малликена, ОЭО атома может быть выражена как арифметическая полусумма его энергий ионизации и сродства к электрону. Чем больше эта величина, тем в большей степени элемент проявляет неметаллические свойства. Наибольшей ОЭО обладает F (4,0), наименьшей — Cs, Fr (0,7).
В пределах главных подгрупп сверху вниз энергия ионизации, энергия сродства к электрону и ОЭО уменьшаются, следовательно, в главных подгруппах сверху вниз увеличиваются металлические свойства элементов, основные свойства гидроксидов и восстановительные свойства соответствующих соединений. В периодах слева направо энергия ионизации, энергия сродства к электрону и ОЭО увеличиваются. В периодах слева направо происходит постепенное уменьшение металлических и нарастание неметаллических свойств.
Самый активный неметалл F является наиболее сильным окислителем, самые активные металлы Rb, Cs, Fr — наиболее сильными восстановителями, а их гидроксиды — самыми сильными основаниями.
Свойства химического элемента в целом определяются зарядом ядра (числом электронов), а положение в периодической системе определяется следующими данными: номер последнего электронного уровня (наибольшее значение n)соответствует номеру периода, число внешних s, s+p или s+d электронов – номеру группы (для d£6). s- и p-элементы образуют главные подгруппы, d – побочные.
Вступая в химическую связь, атомы либо принимают электроны, комплектуя внешний уровень до 8 электронов, либо теряют их, обнажая предыдущий укомплектованный уровень. Атомы металлов содержат небольшое число электронов на внешнем уровне, отдают их и при этом проявляют положительную степень окисления. Максимальная валентность соответствует номеру группы. Атомы неметаллов могут, как отдавать, так и принимать электроны, проявляя в соединениях с кислородом положительную степень окисления (максимальная валентность равна № группы), а в соединениях с водородом – отрицательную (максимальная валентность = (8 - №) группы).
Исходя из строения внешних электронных уровней атомов, можно выделить следующие группы элементов, у которых наблюдается общность химических свойств:
- Элементы с 1-2 s-электронами на внешнем уровне. Это металлы, характеризуются восстановительной активностью, способностью образовывать прочные соединения с неметаллами, вытеснять водород из растворов кислот. Характер оксидов и гидроксидов – основный.
- Элементы с 3-4 электронами на внешнем уровне – ns2np1-2. Это р-элементы, проявляющие свойства как металлов, так и неметаллов. Их оксиды и гидроксиды – амфотерны.
- Элементы с 5-7 электронами на внешнем уровне – ns2np3-4. Это р-элементы, проявляющие характерные свойства неметаллов – высокую окислительную способность, кислотный характер оксидов. Их оксиды и гидроксиды – амфотерны.
- Элементы с завершенными внешними уровнями – ns2np6 – благородные газы. Отличаются отсутствием химической активности.
- Элементы с заполняющимся d-подуровнем. Типичные металлы. Наиболее устойчивы состояния d-подуровня – d0, d5, d10. Оксиды d-элементов проявляют основный характер в низших степенях окисления, амфотерный в промежуточных и кислотный – в высших степенях окисления. d-элементы, завершающие подгруппу – ns2(n-1)d10 близки по свойствам s2-элементам благодаря высокой устойчивости d10.
Пример 1. Приведите электронную формулу элемента с порядковым номером Z =16. Укажите положение этого элемента в периодической системе элементов. Охарактеризуйте его основные химические свойства.
Z = 16. 1s22s22p63s23p4 . Элемент 3 периода, 6 группы, главной подгруппы. Это р-элемент – типичный неметалл. Характер оксидов – кислотный. Максимальная положительная степень окисления равна +6 (ЭО3), максимальная отрицательная равна -2 (Н2Э).
Невозбужденное состояние: 3d
| 3p | ||||||||
| 3s | ¯ | | | |||||
| ¯ | ||||||||
1s22s22p63s23p4 В = 2 (Н2Э)
Возбужденное состояние 1 (*): 3d
| 3p | | |||||||
| 3s | | | | |||||
| ¯ | ||||||||
1s22s22p63s23p33d1 В = 4 (ЭО2)
Возбужденное состояние 2 (**): 3d
| 3p | | | ||||||
| 3s | | | | |||||
| | ||||||||
1s22s22p63s13p33d2 В = 6 (ЭО3)
