Доминирующий тип связи в характеристических оксидах
Оксиды – бинарные соединения элементов с кислородом, выступающим в роли анионообразователя и имеющего степень окисления –2.

!!!!!В соединениях фтора с кислородом анионообразователем выступает более электроотрицательный фтор, поэтому, например, О+1F2 – это не оксид фтора, а фторид кислорода
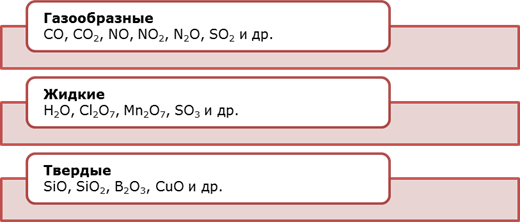
АГРЕГАТНОЕ СОСТОЯНИЕ ОКСИДОВ В Н.У.
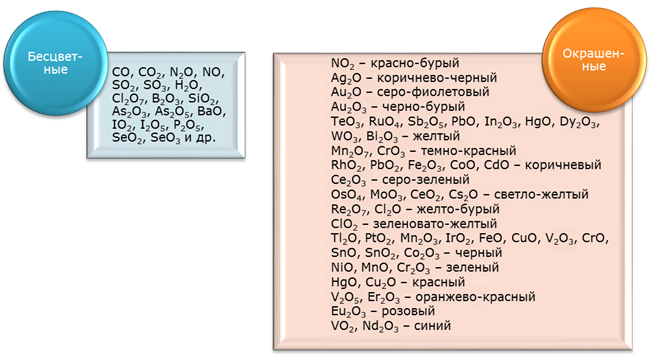
ОКРАСКА ОКСИДОВ В Н.У.
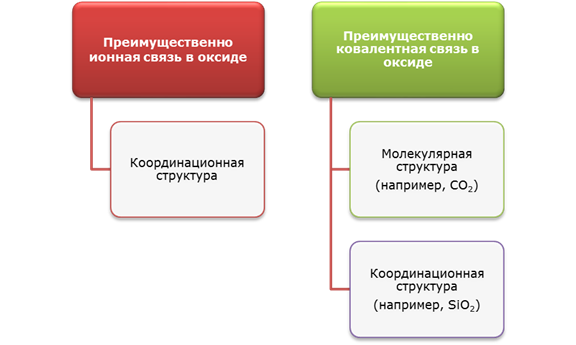
ДОМИНИРУЮЩИЙ ТИП СВЯЗИ В ХАРАКТЕРИСТИЧЕСКИХ ОКСИДАХ
К оксидам также относятся двойные (смешанные) оксиды – образованные атомами одного амфотерного элемента в разных степенях окисления, либо атомами двух разных (металлических, амфотерных) элементов, что и определяет их химические свойства: (Fе+2Fе2+3)О4, (Рb2+2Рb+4)О4, (МgАl2)О4.
Особую группу оксидов составляют несолеобразующие (индифферентные) оксиды – оксиды неметаллов, не имеющие кислотных гидроксидов и не вступающие в реакции солеобразования: СО, N2О, NО, SiО, S2О. Необходимо помнить, что индифферентность – функция оксидов в н.у., т.е. характеристика, зависящая от условий. В специальных условиях индифферентные оксиды могут вступать в реакции солеобразования:
СО + NaOH –(t°,P)® HCOONa (т.е. СО является кислотным оксидом – ангидридом муравьиной кислоты).
N2О – ангидрид азотноватистой кислоты H2N2O2,
NО – ангидрид несуществующей азотноватой кислоты Н2N2O3 и т.д.
Оксиды занимают особое положение среди всех бинарных соединений. Еще Д.И. Менделеев относил «высшие солеобразующие окислы» к характеристическим соединениям. Состав высшего оксида давал возможность определить групповую принадлежность элемента. Свойства оксидов позволяли характеризовать сам элемент как метал или как неметалл. Кроме того, с учетом кислотно-основных свойств оксидов делались выводы о характере соответствующих гидроксидов, а также о составе и свойствах соответствующих солей. На первом этапе становления и развития Периодического Закона роль оксидов как характеристических соединений была очень велика. С развитием теории строения атома и в результате выявления физического смысла Периодического закона, казалось бы, роль характеристических соединений утрачивается. Но периодически изменяются не только свойства элементов, но также формы и свойства их соединений. Поэтому для описания химического облика элементов характеристические соединения по-прежнему играют исключительную роль.
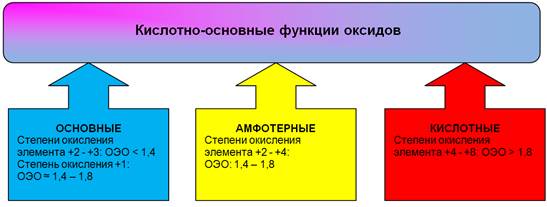
Ориентируясь на разность ОЭО, можно утверждать, что оксиды металлов должны быть преимущественно ионными, а оксиды неметаллов – преимущественно ковалентными. Поскольку для одного и того же элемента с увеличением степени окисления его электроотрицательность растет, то в этом направлении – от низших к высшим оксидам – растет ковалентный вклад. Вследствие этого наблюдается изменение свойств оксидов от основных к кислотным, например, ОЭО(Сr2+) = 1,4; ОЭО(Сr3+) = 1,6; ОЭО(Сr6+) = 2,4, и свойства оксидов закономерно изменяются:
СrО Сr2О3 СrО3
