Обработка результатов эксперимента. 1. Определите изменение температуры раствора ∆T = Тк – Тн
1. Определите изменение температуры раствора ∆T = Тк – Тн
2. Рассчитайте количество теплоты Q (Дж), выделившейся в ходе реакции: Q = (mкис + mшел) ∆Т·С + W·∆T, где mкис и mшел – массы кислоты и щелочи, численно равные их объемам (ρ=1г/см3); С – удельная теплоемкость разбавленного водного раствора (воды) 4,184 Дж/г·К; ∆Т – изменение температуры; W – постоянная калориметра (140,6 Дж/К).
3. Вычислите опытное изменение энтальпии (кДж/моль):
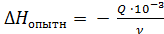 , где ν – количество образовавшейся воды.
, где ν – количество образовавшейся воды.
4. Рассчитайте относительную погрешность опыта, %:
∆ 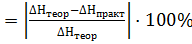
5. Сделайте выводы по работе, обсудите источники погрешностей.
Форма отчета по лабораторной работе
Определение теплового эффекта реакции нейтрализации
Цельработы: освоить методику экспериментального определения теплового эффекта реакции нейтрализации; использовать закон Гесса для расчетов изменения энтальпии, энтропии и свободной энергии системы.
Краткие теоретические основы работы
Тепловым эффектом химической реакции называется
___________________________________________________________________
Обозначение:_____________ единицы измерения___________________
Закон Гесса
_________________________________________________________________________
∆Н0обр.298
___________________________________________________________________
Следствие из закона Гесса:
____________________________________________________________________
Химическая реакция возможна, если для нее ∆G х.р. < 0
Взаимосвязь термодинамических функций ∆G х.р. =________________,
где ∆Gх.р.-____________________ измеряется в__________________
∆Нх.р.-_________________________ измеряется в__________________
∆Sх.р.-__________________________ измеряется в___________________
Т - _________________________________________________________
Исследуемая система: кислота ___________; основание____________
Исследуемая реакция в молекулярном виде
____________________________________________________________
Ионное уравнение реакции
____________________________________________________________________
Рассчитайте изменения термодинамических функций, используя данные приложения 1.
⩟H0 х.р._____________________________________________________________
__________________________________________________________________
⩟S0х.р.
⩟G0х.р.
______________________________________________________________________
Вывод:
______________________________________________________________________
Экспериментальная часть
Таблица 2. Результаты экспериментов и расчетов
| Измеренные и расчетные величины | Обозначение | Единица измерения | Значение |
| Объем кислоты | |||
| Объем щелочи | |||
| Концентрация кислоты | |||
| Концентрация щелочи | |||
| Начальная температура | |||
| Конечная температура | |||
| Удельная теплоемкость воды | |||
| Количество образовавшейся воды | |||
| Тепловой эффект (опытн.)* | |||
| Изменение энтальпии (опытн)** | |||
| Изменение энтальпии (расчетн) |
*) Тепловой эффект рассчитывается по уравнению: Q = (m1 + m2) С·ΔT + W∆T, где m1 и m2 – массы кислоты и щелочи (ρ = 1г/см3); С – удельная теплоемкость разбавленного водного раствора (воды) 4,184 Дж/г·К; ∆T – изменение температуры, W – постоянная калориметра (140,6 Дж/К).
**) Изменение энтальпии: 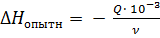 кДж/моль, где Q - тепловой эффект (опытный); v - количество образовавшейся воды.
кДж/моль, где Q - тепловой эффект (опытный); v - количество образовавшейся воды.
Вычисление относительной погрешности опыта, %:
∆ 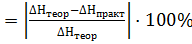
Погрешность опыта___________________________________________
Вывод:_______________________________________________________
____________________________________________________________________
Приложение 1. Стандартные термодинамические величины
| Вещество | ΔН0 обр., кДж/моль | S0o6р., Дж/(моль • К) |
| НСl | -167,46 | 55,10 |
| HN03 | -173,20 | 156,16 |
| NaOH | -469,60 | 49,66 |
| КОН | -481,15 | 91,96 |
| КСl | -418,67 | 157,60 |
| KN03 | -457,78 | 248,9 |
| NaCl | -406,12 | 115,30 |
| NaN03 | -446,23 | 206,60 |
| H20 | -285,84 | 70,10 |
Лабораторная работа № 4. Химическая кинетика (2 часа)
Цель работы: исследование зависимости скорости химической реакции от концентрации реагирующих веществ и температуры.
Рекомендации: познакомьтесь с теоретическими основами работы по литературным источникам.
Важнейшие понятия: истинная и средняя скорости, константа скорости, кинетическое уравнение, молекулярность и порядок реакции, энергия активации, кинетические условия самопроизвольно протекающих процессов, механизм реакции, обратимые и необратимые реакции.
Следует уметь: записывать кинетическое уравнение для гомогенной и гетерогенной реакции; рассчитывать скорость химической реакции в начальный момент и на момент, когда прореагировала часть веществ; определять изменения скорости при изменении концентрации вещества, температуры и давления; рассчитывать энергию активации и константы скорости;
Контрольные вопросы и задания
1. Какие факторы влияют на скорость химических реакций в гомогенных и гетерогенных системах?
2. Как влияет химическая природа реагирующих веществ на скорость химических реакций? Приведите примеры.
3. От каких факторов зависит константа скорости химической реакции?
4. Сформулируйте и запишите закон действующих масс для реакции:
2NO(г) + O2(г) = 2NO2(г)
5. Почему температура влияет на скорость химических реакций? Какизменяется скорость гомогенной реакции при повышении температуры на 40°С, если температурный коэффициент равен 2?
6. Что называется энергией активации? В каких единицах она выражается? Какая из двух реакций протекает с большей скоростью?
СО + Н2О = СО2 + H2 (энергия активации 98 кДж/моль) (1)
2HI = Н2 + I2 (энергия активации 186,4 кДж/моль) (2)
Экспериментальная часть
