Химические свойства металлов. Татьяна С., онлайн репетитор по химии написал(a) 01 ноя 2011
Татьяна С., онлайн репетитор по химии написал(a) 01 ноя 2011
· Химия
Строение атомов металлов определяет не только характерные физические свойства простых веществ – металлов, но и общие их химические свойства.
При большом многообразии все химические реакции металлов относятся к окислительно-восстановительным и могут быть только двух типов: соединения и замещения. Металлы способны при химических реакциях отдавать электроны, то есть быть восстановителями, проявлять в образовавшихся соединениях только положительную степень окисления.
В общем виде это можно выразить схемой:
Ме0 – ne → Me+n,
где Ме – металл – простое вещество, а Ме0+n – металл химический элемент в соединении.
Металлы способны отдавать свои валентные электроны атомам неметаллов, ионам водорода, ионам других металлов, а поэтому будут реагировать с неметаллами – простыми веществами, водой, кислотами, солями. Однако восстановительная способность металлов различна. Состав продуктов реакции металлов с различными веществами зависит и от окислительной способности веществ и условий, при которых протекает реакция.
При высоких температурах большинство металлов сгорает в кислороде:
2Mg + O2 = 2MgO
Не окисляются в этих условиях только золото, серебро, платина и некоторые другие металлы.
С галогенами многие металлы реагируют без нагревания. Например, порошок алюминия при смешивании с бромом загорается:
2Al + 3Br2 = 2AlBr3
При взаимодействии металлов с водой в некоторых случаях образуются гидроксиды. Очень активно при обычных условиях взаимодействуют с водой щелочные металлы, а также кальций, стронций, барий. Схема этой реакции в общем виде выглядит так:
Ме + HOH → Me(OH)n + H2↑
Другие металлы реагируют с водой при нагревании: магний при её кипении, железо в парах воды при красном кипении. В этих случаях получаются оксиды металлов.
Если металл реагирует с кислотой, то он входит в состав образующейся соли. Когда металл взаимодействует с растворами кислоты, он может окисляться ионами водорода, имеющимися в этом растворе. Сокращённое ионное уравнение в общем виде можно записать так:
Me + nH+ → Men+ + H2↑
Более сильными окислительными свойствами, чем ионы водорода, обладают анионы таких кислородосодержащих кислот, как например, концентрированная серная и азотная. Поэтому с этими кислотами реагируют те металлы, которые не способны окисляться ионами водорода, например, медь и серебро.
При взаимодействии металлов с солями происходит реакция замещения: электроны от атомов замещающего – более активного металла переходят к ионам замещаемого – менее активного металла. То сеть происходит замещение металла металлом в солях. Данные реакции не обратимы: если металл А вытесняет металл В из раствора солей, то металл В не будет вытеснять металл А из раствора солей.
В порядке убывания химической активности, проявляемой в реакциях вытеснения металлов друг друга из водных растворов их солей, металлы располагаются в электрохимическом ряду напряжений (активности) металлов:
Li → Rb → K → Ba → Sr → Ca → Na→ Mg → Al → Mn → Zn → Cr → → Fe → Cd→ Co → Ni → Sn → Pb → H → Sb → Bi → Cu → Hg → Ag → Pd → Pt → Au
Металлы, расположенные в этом ряду левее, более активны и способны вытеснять следующие за ними металлы из растворов солей.
В электрохимический ряд напряжений металлов включён водород, как единственный неметалл, разделяющий с металлами общее свойство — образовывать положительно заряженные ионы. Поэтому водород замещает некоторые металлы в их солях и сам может замещаться многими металлами в кислотах, например:
Zn + 2 HCl = ZnCl2 + H2↑ + Q
Металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют его из растворов многих кислот (соляной, серной и др.), а все следующие за ним, например, медь не вытесняют.
СТАНДАРТНЫЙ ПОТЕНЦИАЛ
СТАНДАРТНЫЙ ПОТЕНЦИАЛ (нормальный потенциал), значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активности а всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом электроде, равны 1, а давление газа (для газовыхэлектродов) равно 1,01 · 105 Па (1 атм). Для водных р-ров в качестве стандартного электрода используютводородный электрод (Pt; H2 [1,01·105Па], Н+ [a=1]), потенциал к-рого при всех т-рах принимается равным нулю (см.Электроды сравнения): стандартный потенциал равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схематич. изображении цепи (гальванич. ячейки) водородный электрод всегда записывается слева, исследуемый-справа. Потенциал исследуемого электродасчитается положительным, если в режиме "источник тока" слева направо во внеш. цепи движутся электроны, а в р-ре - положительно заряженные частицы. Напр., стандартный потенциал хлорсеребряного электрода равен эдс гальванич. ячейки
-Pt, Н2[1,01·105Па]|НС1(аb=l)|AgCl, Ag|Pt +
Для любой электродной р-ции, включающей перенос n электронов, электродный потенциал определяется ур-нием:
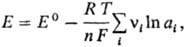
где Е°-стандартный потенциал электрода, R-газовая постоянная, Т-абс. т-ра, F- постоянная Фарадея, аi-термодинамич. активность частиц (как заряженных, так и незаряженных), участвующих в электродной р-ции, vi-стехиометрич. коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электроны входят в левую часть ур-ния, напр. AgCl + е : Ag + С1-). Значения стандартных потенциалов для ряда электродных процессов в водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. Стандартные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляют электрохимический ряд напряжений.
Стандартный потенциал определяется либо непосредственными измерениями эдс соответствующих электрохим. цепей с экстраполяцией на бесконечно разб. р-ры, либо расчетом - по данным о стандартных значениях измененияэнергии Гиббса хим. р-ции DG0. В последнем случае р-цию представляют в виде суммы двух (или более) электродных р-ций, одна из к-рых -окис-лит.-восстановит. р-ция с искомым стандартным потенциалом 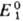 , а другая-с известным стандартным потенциалом .
, а другая-с известным стандартным потенциалом . 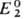 . Если в условной схеме ячейки 1-й электрод записан слева, то
. Если в условной схеме ячейки 1-й электрод записан слева, то
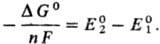

Из ур-ния следует, что стандартные потенциалы, в свою очередь, м.б. использованы для расчета DG0 и константы равновесия К р-ции (ln К = — DG°/RT). Значения E0, рассчитанные на основе значений DG0, представлены в таблице; они далеко не всегда м. б. реализованы в электрохим. цепях из-за того, что предполагаемое равновесиеэлектродной р-ции в действительности может не устанавливаться (это характерно для щелочных, щел.-зем.металлов и большинства орг. в-в в водных р-рах).
В неводных р-рителях стандартные потенциалы также определяют по отношению к потенциалу водородного электрода для каждого отдельного р-рителя. Ведется поиск стандартного электрода, потенциал к-рого можно было бы считать практически не зависящим от природы р-рителя, что позволило бы создать единую шкалу электродных потенциалов. В качестве таких электродов предложены системы: рубидий/ион рубидия, ферроцен/ферроциний-катион и бис(дифенил)хром(I)/ /бис(дифенил)хром(0), потенциалы к-рых из-за большого размера ионов и соотв. малой их сольватации незначительно (по сравнению с потенциалом водородного электрода) зависят от природы р-рителя. Последние два электрода рекомендованы в 1984 ИЮПАК в качестве электродов сравнения в неводных орг. средах.
Выбор электрода сравнения и стандартного состояния исследуемого электрода в системах с расплавами и твердым электролитом в большой мере определяется природой как исследуемого электродного процесса, так и ионного проводника. В широко используемых в качестве электролитов расплавах хлоридов металлов стандартный потенциалберется в хлорной шкале, т. е. в качестве стандартного пользуются хлорным электродом в расплавленном хлориде(графит, Сl2 [1,01 · 105 Па], MC1z [расплав]), где М-металл (на практике обычно берут смесь хлоридов металла).Активность катионов Мz+ в индивидуальном расплаве принимается равной 1. В ряде высокотемпературных гальванич. элементов с твердым электролитом в качестве электрода сравнения применяют оксидные электроды, в частности вюститовый (Pt; Fe, FeO).
Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения ихстандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
| Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au |
Практическое использование ряда напряжений[править | править вики-текст]
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценкикатодных и анодных процессов при электролизе:
· Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении.
· Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
· Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
· При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Таблица электрохимических потенциалов металлов[править | править вики-текст]
| Металл | Катион | φ0, В | Реакционная способность | Электролиз (на катоде): |
| Li | Li+ | -3,0401 | реагирует с водой | выделяется водород |
| Cs | Cs+ | -3,026 | ||
| Rb | Rb+ | -2,98 | ||
| K | K+ | -2,931 | ||
| Ra | Ra2+ | -2,912 | ||
| Ba | Ba2+ | -2,905 | ||
| Fr | Fr+ | -2,92 | ||
| Sr | Sr2+ | -2,899 | ||
| Ca | Ca2+ | -2,868 | ||
| Eu | Eu2+ | -2,812 | ||
| Na | Na+ | -2,71 | ||
| Sm | Sm2+ | -2,68 | ||
| Md | Md2+ | -2,40 | реагирует с водными растворами кислот | |
| La | La3+ | -2,379 | ||
| Y | Y3+ | -2,372 | ||
| Mg | Mg2+ | -2,372 | ||
| Ce | Ce3+ | -2,336 | ||
| Pr | Pr3+ | -2,353 | ||
| Nd | Nd3+ | -2,323 | ||
| Er | Er3+ | -2,331 | ||
| Sm | Sm3+ | -2,304 | ||
| Pm | Pm3+ | -2,30 | ||
| Fm | Fm2+ | -2,30 | ||
| Dy | Dy3+ | -2,295 | ||
| Tb | Tb3+ | -2,28 | ||
| Gd | Gd3+ | -2,279 | ||
| Es | Es2+ | -2,23 | ||
| Ac | Ac3+ | -2,20 | ||
| Dy | Dy2+ | -2,2 | ||
| Pm | Pm2+ | -2,2 | ||
| Cf | Cf2+ | -2,12 | ||
| Am | Am3+ | -2,048 | ||
| Cm | Cm3+ | -2,04 | ||
| Er | Er2+ | -2,0 | ||
| Pr | Pr2+ | -2,0 | ||
| Eu | Eu3+ | -1,991 | ||
| Ho | Ho3+ | -2,33 | ||
| Tm | Tm3+ | -2,319 | ||
| Lu | Lu3+ | -2,28 | ||
| Sc | Sc3+ | -2,077 | ||
| Pu | Pu3+ | -2,031 | ||
| Lr | Lr3+ | -1,96 | ||
| Cf | Cf3+ | -1,94 | ||
| Es | Es3+ | -1,91 | ||
| Th | Th4+ | -1,899 | ||
| Fm | Fm3+ | -1,89 | ||
| Np | Np3+ | -1,856 | ||
| Be | Be2+ | -1,847 | ||
| U | U3+ | -1,798 | ||
| Al | Al3+ | -1,700 | ||
| Md | Md3+ | -1,65 | ||
| Ti | Ti2+ | -1,63 | конкурирующие реакции: и выделение водорода, и выделение металла в чистом виде | |
| Hf | Hf4+ | -1,55 | ||
| Zr | Zr4+ | -1,53 | ||
| Pa | Pa3+ | -1,34 | ||
| Ti | Ti3+ | -1,208 | ||
| Yb | Yb3+ | -1,205 | ||
| No | No3+ | -1,20 | ||
| Ti | Ti4+ | -1,19 | ||
| Mn | Mn2+ | -1,185 | ||
| V | V2+ | -1,175 | ||
| Nb | Nb3+ | -1,1 | ||
| Nb | Nb5+ | -0,96 | ||
| V | V3+ | -0,87 | ||
| Cr | Cr2+ | -0,852 | ||
| Zn | Zn2+ | -0,763 | ||
| Cr | Cr3+ | -0,74 | ||
| Ga | Ga3+ | -0,560 | ||
| Ga | Ga2+ | -0,45 | ||
| Fe | Fe2+ | -0,441 | ||
| Cd | Cd2+ | -0,404 | ||
| In | In3+ | -0,3382 | ||
| Tl | Tl+ | -0,338 | ||
| Co | Co2+ | -0,28 | ||
| In | In+ | -0,25 | ||
| Ni | Ni2+ | -0,234 | ||
| Mo | Mo3+ | -0,2 | ||
| Sn | Sn2+ | -0,141 | ||
| Pb | Pb2+ | -0,126 | ||
| H2 | H+ | |||
| W | W3+ | +0,11 | низкая реакционная способность | выделение металла в чистом виде |
| Ge | Ge4+ | +0,124 | ||
| Sb | Sb3+ | +0,240 | ||
| Ge | Ge2+ | +0,24 | ||
| Re | Re3+ | +0,300 | ||
| Bi | Bi3+ | +0,317 | ||
| Cu | Cu2+ | +0,338 | ||
| Po | Po2+ | +0,37 | ||
| Тс | Тс2+ | +0,400 | ||
| Ru | Ru2+ | +0,455 | ||
| Cu | Cu+ | +0,522 | ||
| Te | Te4+ | +0,568 | ||
| Rh | Rh+ | +0,600 | ||
| W | W6+ | +0,68 | ||
| Tl | Tl3+ | +0,718 | ||
| Rh | Rh3+ | +0,758 | ||
| Po | Po4+ | +0,76 | ||
| Hg | Hg22+ | +0,7973 | ||
| Ag | Ag+ | +0,799 | ||
| Pb | Pb4+ | +0,80 | ||
| Os | Os2+ | +0,850 | ||
| Hg | Hg2+ | +0,851 | ||
| Pt | Pt2+ | +0,963 | ||
| Pd | Pd2+ | +0,98 | ||
| Ir | Ir3+ | +1,156 | ||
| Au | Au3+ | +1,498 | ||
| Au | Au+ | +1,691 |
27.2. Классификация дисперсных систем
По размеру частиц дисперсной фазы различают грубодисперсные системы (взвеси) с размером частиц более 500 нм и тонкодисперсные (коллоидные растворы или коллоиды) с размерами частиц от 1 до 500 нм.
Дисперсные системы классифицируют также по степени взаимодействия между дисперсионной средой и дисперсной фазой. Если такое взаимодействие выражено очень слабо, систему называют лиофобной (в случае воды - гидрофобной). Примером гидрофобной системы может служить «баритовая каша» - осадок сульфата бария, получаемый смешиванием растворов, содержащих катион бария и сульфат-анион. Если же дисперсная фаза и дисперсионная среда «тяготеют» друг к другу (например, образуют водородные связи), образуется лиофилъная (гидрофильная) дисперсионная система. Такие системы образуются самопроизвольно и очень устойчивы. К ним относятся растворы высокомолекулярных соединений, например белков. Многие глобулярные белки диспергированы в водных растворах до отдельных молекул, но, поскольку их размеры составляют десятки нанометров, раствор нельзя считать истинным - это дисперсная система.
Разновидность дисперсных систем.
| Дисперсионная среда | Дисперсная фаза | Название дисперсной системы | Примеры дисперсных систем |
| Газ | Жидкость | Аэрозоль | Туман,облака, карбюраторная смесь бензина с воздухом в двигателе автомобиля. |
| Твердое вещество | Аэрозоль | Дым, смог, пыль в воздухе | |
| Жидкость | Газ | Пена | Газированные напитки, взбитые сливки |
| Жидкость | Эмульсии | Молоко, майонез, жидкие среды организма (плазма крови, лимфа), жидкое содержимое клеток (цитоплазма, кариоплазма) | |
| Твердое вещество | Золь, суспензия | Речной и морской ил, строительные растворы, пасты. | |
| Твердое вещество | Газ | Твердая пена | Керамика, пенопласты, полиуретан, поролон, пористый шоколад. |
| Жидкость | Гель | Желе, желатин, косметические и медицинские средства (мази, тушь, помада) | |
| Твердое вещество | Твердый золь | Горные породы, цветные стекла, некоторые сплавы. |
28.Строение коллоидной мицеллы
Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения степени дисперсности дисперсной фазы (т.е. объединение частиц в более крупные агрегаты) – коагуляцию золей. Тем не менее золям присуща способность сохранять степень дисперсности – агрегативная устойчивость, которая обусловлена, во-первых, снижением поверхностной энергии системы благодаря наличию на поверхности частиц дисперсной фазы двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания частиц дисперсной фазы, имеющих одноименный электрический заряд.
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI ––> AgI + KNO3
Коллоидная мицелла золя иодида серебра (см. рис. 4.9) образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag+ или иодид-ионов. Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+. В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы. Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляютдиффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I–, противоионы – ионы К+) может быть изображена следующим образом:
{[AgI]m · nI– · (n-x)K+}x– · x K+
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:
{[AgI]m · nAg+ · (n-x)NO3–}x+ · x NO3–
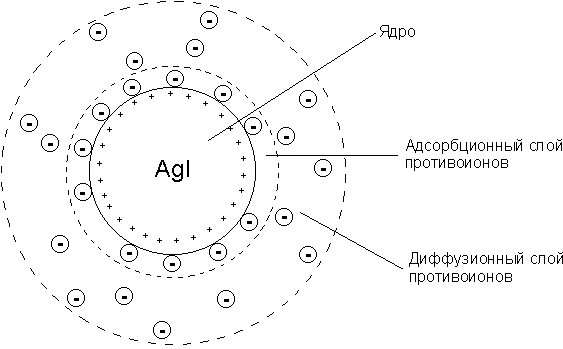
Рис. 4.9. Строение коллоидной мицеллы
Агрегативная устойчивость золей обусловлена, таким образом, рядом факторов: во-первых, снижением поверхностной энергии дисперсной фазы (т.е. уменьшения движущей силы коагуляции) в результате образования двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания имеющих одноименный заряд коллоидных частиц и противоионов. Еще одна причина устойчивости коллоидов связана с процессом гидратации (сольватации) ионов. Противоионы диффузного слоя сольватированы; эта оболочка из сольватированных противоионов также препятствует слипанию частиц.
26.жесткость воды.ее виды.
58. Жесткость воды и способы ее устранения
Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется жесткой водой. Если соли присутствуют в воде в небольших количествах или отсутствуют, то вода называется мягкой. В жесткой воде мыло плохо пенится, поскольку соли кальция и магния образуют с ним нерастворимые соединения. В ней плохо развариваются пищевые продукты. При кипячении на стенках паровых котлов образуется накипь, которая плохо проводит теп-лоту, вызывает увеличение расхода топлива и изнашивание стенок котла. Жесткой водой нельзя пользоваться, проводя ряд технологических процессов (крашение). Образование накипи: Са + 2НСО3 = Н2О + СО2 + СаСО3?.
Перечисленные выше факторы указывают на необходимость удаления из воды солей кальция и магния. Процесс удаления этих солей называется водоумягчением, является одной из фаз обработки воды (водоподготовки).
Водоподготовка – обработка воды, используемая для различных бытовых и технологических процессов.
Жесткость воды подразделяется на:
1) карбонатную жесткость (временную), которая вызывается наличием гидрокарбонатов кальция и магния и устраняется с помощью кипячения;
2) некарбонатную жесткость (постоянную), которая вызывается присутствием в воде сульфитов и хлоридов кальция и магния, которые при кипячении не удаляются, поэтому она называется постоянной жесткостью.
Верна формула: Общая жесткость = Карбонатная жесткость + Некарбонатная жесткость.
Общую жесткость ликвидируют добавлением химических веществ или при помощи катиони-тов. Для полного устранения жесткости воду иной раз перегоняют.
При применении химического метода растворимые соли кальция и магния переводят в нерастворимые карбонаты:
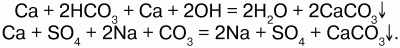
Более модернизированный процесс устранения жесткости воды – при помощи катионитов.
Катиониты – сложные вещества (природные соединения кремния и алюминия, высокомолекулярные органические соединения), общая формула которых – Na2R, где R – сложный кислотный остаток.
При пропускании воды через слой катионита происходит обмен ионов (катионов) Na на ионы Са и Mg: Са + Na2R = 2Na + CaR.
Ионы Са из раствора переходят в катионит, а ионы Na переходят из катионита в раствор. Чтобы восстановить использованный катионит, его необходимо промыть раствором поваренной соли. При этом происходит обратный процесс: 2Na + 2Cl + CaR = Na2R + Ca + 2Cl.
25.ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:
Реагенты Продукты Продукты |
Все химические реакции, в принципе, обратимы.
Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ).
Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты.
Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу:
Fe + S FeS FeS |
Пример. Реакция синтеза аммиака является обратимой:
N2 + 3H2  2NH3 2NH3 |
При 200 атм и 400 0С достигается максимальное и равное 36% (по объему) содержание NH3 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается.
Прямая и обратная реакции протекают одновременно в противоположных направлениях.
| Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия. |
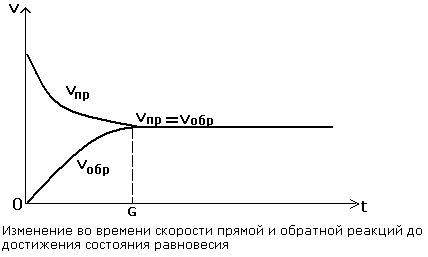
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
