Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
Удельная электроотрицательность дистиллированной воды составляет:
c=5.48*10-8 Ом-1*см-1
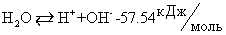 (термохимическое правило знаков т.е. теплота поглощается)
(термохимическое правило знаков т.е. теплота поглощается)
Kд=[H+][OH-]/[H20]=1.86*10-18 при t=220
Вода-смесь молекул воды, катионов водорода и анионов гидроксила, в знаменателе – концентрация недиссоциированных молекул воды в воде.
KД[H2O]=[H+][OH-]=KВ – ионное произведение воды.
Полагаем, что концентрация недиссоциированных мол-л воды в воде равна общей мольной концет-ии воды.
[H2O]=1000/18.016=55.56 моль/л
КВ=[H+][OH-]=1.8*10-16*55.56=10-14 при t=220С
Поскольку процесс диссоц-ии воды – пр-сс эндотермический, то с ростом температуры дис-ция воды будет усиливаться,. а значит ионное произведение воды будет увеличиваться.
КВ=а*10-14
| t0C | a | KB |
| 0.13 | 0.13*10-14 | |
| 1.0 | 10-14 | |
| 1.008 | … | |
| 5.66 | … | |
| 74.0 | … |
[H+]=[OH-] – условие нейтральности воды.
[H+]=КВ=1.008*10-14=1.004*10-7 г-ион/л
Мы можем определить a:
a=[H+]/[H20]=1.004*10-7/55.56=1.8*10-9 при t=250C
нейтральный раствор:[H+]=10-7 г-ион/л
кислый раствор: [H+]>10-7 г-ион/л
щелочной раствор: [H+]<10-7 г-ион/л
Допустим : [H+]=10-4; КВ=[H+][OH-]=10-14
Отсюда находим [OH-]=КВ/[H+]=10-10
10-4>10-10Ю[H+]>[OH=],Ю раствор имеет кислую реакцию. Т.к. неудобно иметь дело с отрицательными степенями договорились степень кислотности растворов оценивать при помощи водородного покпзателя pH=-lg[H+]
нейтральный раствор pH=7
кислый раствор pH<7
щелочной рас-р pH>7
Сок лимона-2.1, черный кофе-5, дождевая вода-6.5, кровь здоровогочел-ка-7.4.
Индикаторы-это слабые органич-ие кислотыили основания, к-ые меняют окраску при изменении велечины pH.
Нинд«Н++инд - (лакмус, фенолфталеин)
индОН«инд++ОН-
DрН для лакмуса=3ед(5ё8) или 2ед(6ё8) (красный окрас®синий окрас)
Молекулы лакмуса – красные, ионы – синие. В кислоте равновесие смещается влево – к красному, в щелочи водород связывается, равновесие вправо к синему.
Фенолфталеин – кислота. Молекулы – бесцветные, а анион (инд-) емеет малиновый цвет). Если введем в рас-р щелочи, то за счет связывания катионов Н, получается малиновый цвет, в кислом рас-ре окрас бесцветный.
| Наименование Инд | кислота или основание | интервал изменения рН | изменение окраски |
| метил-оранж | основание | 3.1-4.4 | красный-желтый |
| метил-рот | основание | 4.2-6.3 | красный-желтый |
| лакмус | кислота | 5(6)-8 | красный-синий |
| ф-фталеин | кислота | 8.3-9.8 | бесцвет-малиновый |
| тимолфталеин | кислота | 9.8-10.5 | бесцвет- синий |
Универсальный Инд-смесь целого ряда инд-оров.
Гидролиз солей.
-разложение солей под действием воды.
С точки зрения теории электрической диссоциации, кислота – вещ-во, кот-е в водном раст-ре отщепляет только 1-н вид катионов – Н+. НnA«nH++An-.Основание – такое вещ-во,кот-е в водном р-ре отщепляет только 1-н вид анионов – анионы гидроксила. Me(OH)p «Mep++pOH- - нейтрализация. Наряду с кислотами и основ-ми сущ-ют амфолиты – вещ-ва, кот-е в зависимости от величины РН могут дисс-ть или по схеме кис-ты или по схеме основ-я. Zn(OH)2, Cr(OH)3.. Zn(OH)2«Zn2+ +2OH-«H2ZnO2«2H++ZnO22- Гидролиз – реакция обратная р-ции нейтрализации. Если ра-ряем соль в воде, то соль диссоц-т на ионы (катион и анион), но одновременно вода диссоц-т на катион водорода и ОН-. Ионы соли могут связываться с Н+ и ОН-. Если степень связанности Н+ с ионами соли будет >, чем ОН-, то р-р соли перейдет в щелочную реакцию, если будут > связаны ОН-, то в кислую р-ю.
Примеры гидролиза.
1) соль слабой к-ты и сильного основ-я.
CH3COONa«CH3COO-+Na+
H2O« Н++ OH-
CH3COONa+ H2O® CH3COOH+NaOH
Раствор соли, образов-й слабой кисло-й и силь-м основанием имеет РН>7
Константа гидролиза КГ – это константа равновесия реакции гидролиза.
КГ = Кв/КД[CH3COOH]
КГ = [CH3COOH] [OH-]/[CH3COO-] [H20] КГ = [CH3COOH] [OH] [H+]/[CH3COO-] [H+]
КД CH3COOH =[CH3COOH-] [H+]/[CH3COOH]
2) соль слабой 2-х – основной кислоты и сильного основания.
1 ступень: Na2CO3+H20=NaHCO3+NaOH 2 ступень: NaHCO3 +H20= NaOH+H2CO3
{ионный вид} РН>7 {ионный вид} PH>7
3) cоль сильной к-ты и слабого основания
NH4Cl+H20=HCL+NH4OH PH>7
4)соль сильной к-ты и слаб многоатомного основ-я Al2CO3®AlOHCl2®Al(OH)2Cl®Al(0H)3
5) соль сильной к-ты и силь. основ-я
KNO3+H2O=KOH+HNO3 Гидролизу не подвергается.Р-р такой соли имеет нейтральную р-цию. РН=7
6) соль слаб к-ты и слаб основ-я CH3COONH4+H20=CH3COOH+NH4OH
КГ = Кв/КД CH3COOHКД NH4OH Если к-та сильнее основания , то р-р имеет кислую р-цию, если основ-е сильнее, то щелоч-ю реакц-ю
7 ) соль очень слаб к-ты и очень слаб основ-я Al2S3+6H20=2Al(OH)3Ї+3H2S2. Соль подвергается полному гидролитическому разложению.
Степень гидролиза h=число гидролизов молей соли / общ число растворен-х молей соли *100%. h увеличив-я с ростом t° и с ростом разбавления. h при t т.к. Кв с ростом
SbCl3+2H20«ЇSb(OH)2Cl+2HCl РН>7 Р-ры многих солей во избежание гидролиза можно хранить в подкисленном или в подщелочном виде.
