Выберите один правильный ответ. 1. Удельная электрическая проводимость – это:
1. Удельная электрическая проводимость – это:
1) Мера электропроводящей способности электролита.
2) Электропроводность слоя электролита, находящегося между электродами, расположенными на расстоянии 1 см друг от друга.
3) Электропроводность слоя электролита, находящегося между электродами, имеющими площадь 1 см2.
4) Электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по одному квадратному метру и расположенными на расстоянии одного метра друг от друга.
2. Электропроводность обратно пропорциональна:
1) Силе тока. 3) Напряжению.
2) Сопротивлению. 4) Мощности.
3. Закон независимого движения ионов в бесконечно разбавленных растворах носит название:
1) Закон Оствальда.
2) Закон Кольрауша.
3) Закон Дебая.
4) Закон Гесса.
4. Что влияет на молярную электропроводность раствора электролита?
1) Природа иона.
2) Концентрация раствора.
3) Температура раствора.
4) Все перечисленные факторы.
5. Подвижность какого из ионов будет наибольшей, если не брать во внимание гидратацию ионов:
1) Na+. 2) Mg2+. 3) Al3+. 4) Для всех одинакова.
6. Почему протоны обладают аномальной подвижностью?
1) Т.к. имеют малый размер.
2) Т.к. из-за малого размера сильно поляризованы.
3) Т.к. могут перемещаться перескоком от одной молекулы воды к другой.
4) По всем ранее перечисленным причинам.
7. Укажите причину снижения молярной электропроводности при увеличении концентрации в сильных электролитах:
1) Уменьшение степени диссоциации.
2) Увеличение сил межионного взаимодействия.
3) увеличение числа носителей заряда.
4) Уменьшение сил межионного взаимодействия.
8. Электропроводность какого из растворов при бесконечном разбавлении будет наибольшей:
1) NaCl. 2) MgCl2. 3) AlCl3. 4) AlPO4.
9. Как называется метод введения ионов в организм человека под действием электрического тока:
1) Электролиз. 3) Ионофорез.
2) Электродиффузия. 4) Электрофорез.
10. Выражение для определения молярной электропроводности через удельную имеет вид:
1) æ×С. 2) æ/С. 3) С/æ. 4) 2С/æ.
Равновесные электродные процессы. Электрохимические цепи
Электрохимические цепи – системы, состоящие из двух электродов, помещенных в раствор электролита или в два раствора, находящихся в контакте друг с другом. Электрохимические цепи, способные вырабатывать электрическую энергию, называют гальваническими элементами.
Классификация цепей
В химических цепях источником электрической энергии является энергия Гиббса протекающей в системе окислительно-восстановительной («токообразующей») химической реакции. Реакции окисления и восстановления («полуреакции») в гальваническом элементе протекают на разных электродах, т.е. пространственно разделены. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, - катод. Электроны, образующиеся в процессе окисления на аноде, перемещаются по внешней цепи к катоду, на котором они участвуют в процессе восстановления. Комбинируя различные окислительно-восстановительные полуреакции, можно получить большое число гальванических элементов.
Концентрационные цепи состоят из одинаковых электродов, но отличаются концентрацией веществ, участвующих в окислительно-восстановительных процессах. Концентрационные цепи можно составить из электродов первого и второго рода с разной концентрацией растворов или из газовых электродов с разными давлениями газов.
Электрохимическая цепь называется правильно разомкнутой, если на ее концах находятся одинаковые металлы. На практике это обычно достигается подключением к обоим концам электрохимической цепи проводников из одного и того же металла (например, медных). Разность потенциалов на концах правильно разомкнутой цепи называется электродвижущей силой (ЭДС).
Если гальванический элемент работает обратимо при постоянных температуре и давлении, то его ЭДС однозначно связана с ∆G протекающей в нем химической реакции. В этих условиях уменьшение энергии Гиббса равно полезной работе, которую может совершить гальванический элемент:
∆G = - zF∆E, (1)
где z – число электронов, участвующих в реакции, F – постоянная Фарадея, ∆Е – ЭДС элемента.
Электрохимические цепи являются равновесными только в том случае, если они не содержат границы раздела между разными растворами (т.е. являются цепями без переноса) и, кроме того, если ЭДС цепи скомпенсирована разностью потенциалов от внешнего источника электрического тока. Цепи с переносом не являются полностью равновесными, поскольку на границе раздела двух растворов происходит диффузия катионов и анионов. В результате на границе раздела возникает диффузионный потенциал – дополнительная разность потенциалов, обусловленная разной скоростью переноса катионов и анионов через границу. Диффузионный потенциал вносит неопределенный вклад в ЭДС цепи, точно рассчитать его невозможно, поскольку неизвестны активности отдельных ионов. Для уменьшения диффузионного потенциала между растворами помещают солевой мостик – концентрированный раствор нейтральной соли, подвижность катиона и аниона которой приблизительно одинаковы (КСl, KNO3, NH4NO3). В результате одна граница между двумя растворами заменяется двумя границами: раствор 1 – солевой мостик и солевой мостик – раствор 2. Диффузионные потенциалы на этих границах близки по величине и противоположны по знаку, поэтому их суммарный вклад в ЭДС резко уменьшается, и им можно пренебречь по сравнению с ошибкой эксперимента.
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля-Якоби):
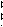 Zn│ZnSO4 CuSO4│Cu или Zn│ZnSO4 ║ CuSO4│Cu
Zn│ZnSO4 CuSO4│Cu или Zn│ZnSO4 ║ CuSO4│Cu
 где сплошная вертикальная линия│обозначает границу раздела между разными фазами, пунктирная вертикальная линия – границу между разными растворами, а двойная сплошная вертикальная линия ║ - солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
где сплошная вертикальная линия│обозначает границу раздела между разными фазами, пунктирная вертикальная линия – границу между разными растворами, а двойная сплошная вертикальная линия ║ - солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные реакции (как окислительные, так и восстановительные) обычно записывают как реакции восстановления, поэтому общая реакция в гальваническом элементе записывается как разность между реакциями, протекающими на правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu.
Левый электрод: Zn2+ + 2e = Zn.
Общая реакция: Сu2+ + Zn = Cu + Zn2+.
ЭДС элемента равна разности потенциалов правого (катода) и левого (анода) электродов:
∆Е = Еп – Ел или же ∆Е = ЕК – ЕА (2)
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно, поскольку, согласно уравнению (1), для этой реакции ∆G < 0. Если ЭДС элемента отрицательна, то самопроизвольно протекает обратная реакция.
Электродные потенциалы
Потенциал Е электрода рассчитывают по формуле Нернста:
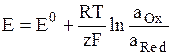 (3)
(3)
где аOx и aRed – активности окисленной и восстановленной форм вещества, участвующего в электродной реакции, Е0 – стандартный потенциал электрода (при аOx = aRed = 1), R – газовая постоянная, Т – абсолютная температура. При 298 К:
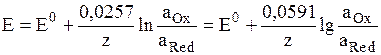 (4)
(4)
Соответственно, стандартная ЭДС гальванического элемента равна разности стандартных потенциалов
∆Е0 = Е0К – Е0А (5)
и связана со стандартной ∆G0 протекающей в нем химической реакции
∆G0 = -zF∆E0. (6)
Абсолютное значение электродного потенциала определить невозможно. На практике измеряют разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения. Стандартные электродные потенциалы измеряют в условиях, когда активности всех участников реакции, протекающей на исследуемом электроде, равны единице, а давления газа (для газовых электродов) равно 105 Па (1 бар). Для водных растворов в качестве электрода сравнения используют стандартный водородный электрод, потенциал которого при всех температурах принят равным нулю. Стандартный электродный потенциал Е0 электрода равен стандартной ЭДС электрохимической цепи, составленной из исследуемого электрода и стандартного водородного электрода. При схематическом изображении такой цепи водородный электрод записывают слева, а исследуемый электрод справа. Например, стандартные водородные потенциалы цинкового и медного электродов определяются как ЭДС цепей
Pt│H2│H+║Zn2+│Zn,
Pt│H2│H+║Сu2+│Cu
и равны Е0(Zn2+/Zn) = -0,760В и Е0(Cu2+/Cu) = 0,340В при 250С.
Значения некоторых стандартных электродных потенциалов приведены в приложении.
Зная значения стандартных потенциалов, можно рассчитать стандартную ЭДС гальванического элемента. Например, для элемента Даниэля-Якоби стандартная ЭДС равна Е0 = Е0(Cu2+/Cu) - Е0(Zn2+/Zn) = 0,337 – (- 0,763) = 1,100В.
Классификация электродов
Электроды классифицируют по химической природе веществ, участвующих в электродном процессе.
В электродах первого рода восстановленной формой является металл электрода, а окисленной формой – ионы этого металла. Как правило, электроды первого рода обратимы по катиону (т.е. их потенциал является функцией активности катиона). Примерами электрода первого рода являются электроды элемента Даниэля-Якоби:
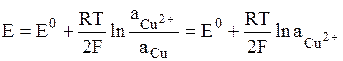 ,
,
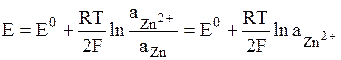 .
.
Если в электродных процессах участвуют чистые твердые или жидкие вещества, то их активности равны единице.
Общее уравнение для электродов I рода имеет вид:
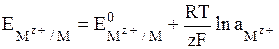 . (7)
. (7)
К электродам первого рода относятся амальгамные электроды, в которых восстановленной формой является – сплав металла с ртутью (элемент Вестона) Cd2+ + 2e = Cd(Hg):
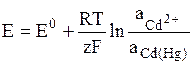 .
.
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимой соли, погруженного в раствор, содержащий анионы этой соли. Окисленной формой является труднорастворимая соль, а восстановленной – металл и анион соли. Электроды второго рода обратимы по аниону (т.е. их потенциал является функцией активности аниона). Примерами электродов второго рода являются следующие широко распространенные электроды сравнения:
- хлоридсеребряный электрод (обозначается Ag│AgCl│Cl-);
электродная реакция AgCl + e = Ag + Cl-,
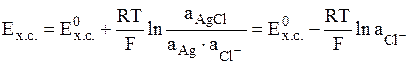 .
.
- каломельный электрод (обозначается Hg│Hg2Cl2│Cl-);
электродная реакция Hg2Cl2 + 2e = 2Hg + 2Cl-,
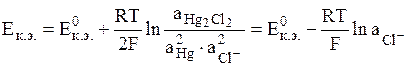
Общий вид уравнения Нернста для электродов II рода:
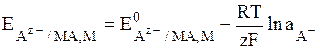 (8)
(8)
Окислительно-восстановительные, или редокс-электроды состоят из инертного металла, который не участвует в реакции, а является переносчиком электронов между окисленной и восстановленной формами вещества.
Одним из лучших материалов для реализации окислительно-восстановительного равновесия является платина, в качестве же реагента можно взять, например, хингидрон. Это эквимолярная смесь хинона С6Н402 и гидрохинона С6Н4(ОН)2, между которыми в водном растворе в присутствии платины устанавливается электрохимическое равновесие:
С6Н4О2 +2 Н30+ + 2е = С6Н4(ОН)2 + 2 Н2О.
Потенциал, устанавливающийся на Pt-электроде при рН < 8.5, определяется лишь активностью ионов гидроксония:
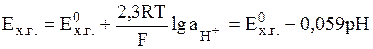 (9)
(9)
поскольку активности хинона и гидрохинона примерно равны, а активность воды близка к единице. Стандартный потенциал хингидронного электрода Е0хг при 298 К составляет 0,699 В.
К окислительно-восстановительным электродам относятся газовые электроды. Газовый электрод состоит из инертного металла, к которому попадает газ, участвующий в электродном процессе. Восстановленной формой является газ, а окисленной – ионы в растворе. Наиболее известным примером газового электрода является водородный электрод. Его записывают в виде: Pt│H2│H+; электродная реакция: 2Н+ + 2е = Н2; уравнение для определения потенциала:
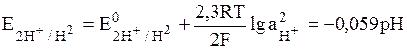 (10)
(10)
Если два раствора разделены физической границей конечной толщины, обладающей избирательной пропускной способностью по отношению к частицам различного сорта, то такая граница является мембраной. На основе полупроницаемых мембран, обладающих повышенной избирательностью к определенным ионам, созданы ионселективные электроды. С определенным допущением к ионселективным электродам с твердой мембраной относят стеклянный электрод, селективный по отношению к ионам Н3О+. Как показывает теоретический анализ, если рН < 12, то потенциал стеклянного электрода описывается формулой:
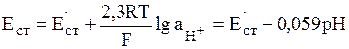 (11)
(11)
В этом выражении Е'ст является константой для данного электрода, т.к. зависит от сорта стекла, типа электрода сравнения и ряда иных факторов.
Хингидронный, водородный и стеклянный электроды часто применяют для определения рН растворов.
Примеры решения задач
Пример 1.
Вычислить электродный потенциал медного электрода в растворе, содержащем 1,6 г CuSO4 в 200 мл раствора при 298 К. Кажущаяся степень диссоциации соли в растворе равна 0,4.
Решение:
Находим молярную концентрация CuSO4.
с(CuSO4) = ν(CuSO4) / Vр-ра = m(CuSO4) / M(CuSO4)∙Vр-ра = = 1,6г / 160г/моль∙0,2л = 0,05моль/л.
Концентрация потенциалопределяющих ионов Cu2+ будет равна:
c(Сu2+) = α∙ с(CuSO4) =0,4∙0,05моль/л = 0,02моль/л.
Из справочника находим значение стандартного электродного потенциала: Е0(Cu2+/Cu) = 0,34В. По уравнению Нернста рассчитываем электродный потенциал:
Е(Cu2+/Cu) =0,34В + 2,3∙8,31(Дж/мольК)∙298К∙lg0,02моль/л / 2∙96500Кл/моль = 0,37 В.
Ответ: 0,37 В.
Пример 2.
Вычислить ЭДС медно-цинкового элемента при 298К, в котором концентрация ионов меди 0,0002 моль/л, а ионов цинка – 0,5 моль/л, gCu2+ = 1, gZn2+ = 0,4.
Решение:
Вычисляем ЭДС
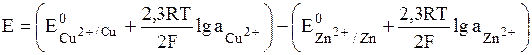 , где аi » Сi∙gi.
, где аi » Сi∙gi.
Значения стандартных электродных потенциалов находим в справочнике: Е0(Cu2+/Cu) = 0,34В; Е0(Zn2+/Zn) = -0,76В, отсюда:
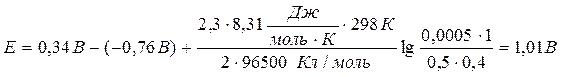
Ответ: 1,01В.
Пример 3.
При 298К ЭДС гальванического элемента, составленного из нормального водородного электрода и хингидронного электрода, приготовленного на основе исследуемого раствора, равна 0,2864В. Вычислить рН исследуемого раствора.
Решение:
По уравнению (1.28) для Т = 298 К имеем:
рН = (Е0х.г – Ех.г) / 0,059 = (0,6994В – 0,2864В) / 0,059 = 7.
Значение Е0х.г. = 0,6994 В взято из справочника.
Ответ: 7.
