Робота 3.1. Визначення константи електролітичної комірки.
Мета роботи:визначити константу комірки для вимірювання електропровідності розчинів електролітів.
Електролітична комірка (посудина для вимірювання електропровідності) – це скляна ємність, в яку зазвичай впаяно два платинованих платинових електроди. Оскільки для певної комірки невідомі площа електродів та відстань між ними, то спочатку потрібно визначити її константу – відношення відстані між електродами до їх площі:
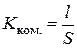 . (3.11)
. (3.11)
Для цього комірку заповнюють розчином електроліту з відомою питомою електропровідністю (зазвичай 0,02 М розчин KCl, табл. 3.1) в такій кількості, щоб були покриті електроди, розміщують її у термостаті, який налаштовано на певну температуру, витримують протягом 8 – 10 хв. і вимірюють опір.
Таблиця 3.1. Питома електропровідність 0,02 М розчину KCl за різних температур
| t, о С | ||||||||
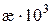 ,См/см ,См/см | 2,40 | 2,45 | 2,50 | 2,55 | 2,61 | 2,66 | 2,71 | 2,77 |
Згідно з рівняннями (3.2) і (3.11) константа комірки визначається за формулою:
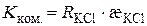 . (3.12)
. (3.12)
Звіт
1. Температура досліду: 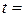 о С.
о С.
2. Питома електропровідність стандартного розчину КСl: 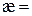 См/см.
См/см.
3. Опір стандартного розчину КСl: 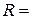 Ом.
Ом.
4. Обчислення константи комірки за рівнянням (3.12): 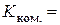 см -1.
см -1.
Робота 3.2. Дослідження електропровідності розчинів сильних та слабких електролітів.
Мета роботи:визначити питому, молярну електропровідності розчинів електролітів, ступінь дисоціації слабкого електроліту та коефіцієнт електропровідності сильного електроліту.
В електролітичну комірку наливають розчин сильного електроліту (за вказівкою викладача) і після термостатування за стандартної температури вимірюють його опір. Після цього посудину для вимірювання електропровідності промивають дистильованою водою і наливають в неї піпеткою 10 см3 розчину слабкого 1–1-валентного електроліту (за вказівкою викладача), термостатують і вимірюють опір.
Питому електропровідність розчинів обчислюють за формулою:
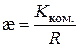 . (3.13)
. (3.13)
Молярну електропровідність електроліту  розраховують за формулою (3.4), граничну молярну електропровідність
розраховують за формулою (3.4), граничну молярну електропровідність 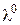 визначають за довідниковими даними на основі рівняння (3.7). Для сильних електролітів обчислюють коефіцієнт електропровідності (за 3.9), для слабких – ступінь дисоціації (за 3.8). Виміряні та розраховані величини зводять у табл. 3.2.
визначають за довідниковими даними на основі рівняння (3.7). Для сильних електролітів обчислюють коефіцієнт електропровідності (за 3.9), для слабких – ступінь дисоціації (за 3.8). Виміряні та розраховані величини зводять у табл. 3.2.
Звіт
1. Температура досліду: 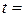 о С.
о С.
2. Таблиця 3.2. Результати експерименту та обчислень
| № | Електроліт | с, моль/дм3 | R, Ом |  , См/см , См/см |  , См×см2/моль , См×см2/моль | 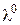 , См×см2/моль , См×см2/моль | 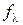 або або  |
Обчислення для сильного електроліту:
Обчислення для слабкого електроліту:
3. Висновок.
