Расчет нормальной концентрации
Нормальная концентрация (эквивалентная) показывает количество эквива лентов растворенного вещества в 1 л раствора.
СN=  =
=  . (18)
. (18)
Количество эквивалентов растворенного вещества определяется:
nЭ в-ва = 
 ® CN =
® CN = 
где nЭ в-ва – число эквивалентов растворенного вещества, г/экв.;
mв-ва – масса растворенного вещества, г;
MЭ в-ва – масса эквивалента растворенного вещества, г/экв;
uр-ра – объем раствора, л.
Рассчитаем массу эквивалента К2СО3. Масса 1 моля К2СО3 равна:


Масса моль – эквивалента К2СО3: 

где В – суммарная валентность катиона или аниона соли и для К2СО3 равна 2.
Вычислим количество грамм-эквивалентов К2СО3 в растворе:
n  =
=  .
.
Определим объем полученного раствора по формуле:
u=  ,
,
где m – масса раствора, г;
u - объем раствора, мл;
r - плотность раствора, г/см3.
u 
По определению найдем нормальную концентрацию раствора:
СN =  .
.
Расчет молярной концентрации
Молярная концентрация определяется количеством молей растворенного вещества, содержащихся в 1 л раствора. Количество молей растворенного вещества равно:
nв-ва = 
следовательно, молярная концентрация раствора:
 ,
,  (19)
(19)
где n – количество молей растворенного вещества, моль;
mв-ва- масса растворенного вещества, г;
Mв-ва- молекулярная масса растворенного вещества, г/моль;
uр-ра- объем раствора, л.
Зная процентную концентрацию и плотность (r) полученного раствора, можно определить молярную концентрацию этого раствора.
Масса 1л раствора К2СО3:
mр-ра = uр-ра × r = 1000 см3×1,02 г/см3 = 1020 г.
Теперь определим массу растворенного К2СО3 в 1 л раствора:
m  = mр-ра ×w
= mр-ра ×w  ,
,
где w  =
=  - массовая доля растворенного вещества, равная отношению массы растворенного вещества к массе всего раствора:
- массовая доля растворенного вещества, равная отношению массы растворенного вещества к массе всего раствора:
w  =
=  .
.
Отсюда m  = 1020 г × 0,0196 =19,99 г.
= 1020 г × 0,0196 =19,99 г.
Находим молярную концентрацию раствора, т.е. количество молей К2СО3 в 1 л раствора:
СМ= 

Расчет моляльной концентрации раствора
Моляльность раствора (Сm) показывает количество молей растворенного вещества, содержащихся в 1000 г растворителя:
Сm= 
 ;
;
т.к. nM =  ,
,
где nM - количество молей растворенного вещества;
mв-ва – масса растворенного вещества, г;
Mв-ва – молярная масса растворенного вещества, г/моль;
mр-ля – масса растворителя, кг,
то Сm =  .
.  (20)
(20)
Найдем массу К2СО3, растворенного в 1 кг растворителя (Н2О). Для этого определим массовую долю растворителя wр-ля:
w  =
=  .
.
Масса К2СО3 в одном кг растворителя:
 .
.
Пример 2. Вычислите массовые доли веществ в растворе, полученном при сливании 100 мл 10%-го раствора СаСl2 (r1= 1,083 г/мл) и 150 мл 4%-го раствора Nа3РО4(r2 = 1,04 г/мл) после отделения образовавшегося осадка.
Решение. Запишем уравнение реакции, протекающей при сливании данных растворов:
3СаСl2 + 2Nа3РО4 = 6NаСl + Cа3 (РО4)2¯.
Эта реакция необратима, т.к. Cа3(РО4)2 выпадает в осадок.
Разобьем решение задачи на следующие этапы:
1) Вычислим массы растворов и растворенных веществ.
Раствор СаСl2: m1 (р-ра) = r1× u1 = 1,083 × 100 = 108,3 г.
Раствор Nа3РО4: m2 (р-ра) = r2 × u2 = 1,04 × 150 = 156 г.
mCаСl 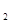 = m1 × w1 = 108,3 × 0,1 = 10,83 г,
= m1 × w1 = 108,3 × 0,1 = 10,83 г,
т.к.× w1 =  ;
;
mNа 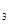 РО
РО  = m2 × w2 = 156 × 0,04 = 6,24 г,
= m2 × w2 = 156 × 0,04 = 6,24 г,
т.к.× w2 = 
2) Находим количество вещества СаСl2 и Nа3РО4::
nCаСl  =
=  ;
;
n  =
=  .
.
3) Из уравнения реакции видим, что вещества реагируют в соотношении 3:2 и из расчета по этапу 2) очевидно, что СаСl2 находится в избытке, а Nа3РО4 прореагирует полностью.
4) Находим массы образовавшихся веществ, т.к. количество образовавшегося фосфата кальция в 2 раза меньше количества молей Nа3РО4, вступившего в реакцию:
n  =
= 

 ,
,
m  0,01904×310,2 = 5,906 г;
0,01904×310,2 = 5,906 г;
nNаСl = 3n(  )
)  = 0,1142 моль;
= 0,1142 моль;
mNаСl = n×M = 0,1142 × 58,44 = 6,674 г.
5) Находим массу остатка СаСl2; прореагировало СаСl2:
n3 = 3/2 n(  ) =0,05711 моль;
) =0,05711 моль;
m1(CаСl  ) =n3×MCаСl
) =n3×MCаСl 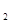 = 6,339 г;
= 6,339 г;
mостатка= 10,83 - 6,339 = 4,491 г.
6) Вычислим массу образовавшегося раствора:
m3(р-ра)= m1(р-ра)+m2(р-ра) – m 
 = 108,3 + 156 – 5,906 = 258,39 г.
= 108,3 + 156 – 5,906 = 258,39 г.
7) Вычислим массовые доли солей в растворе:

w NаСl =  .
.
Пример 3. На нейтрализацию 50 см3 раствора НСl израсходовано 25 см3 0,5 н раствора едкого натра. Чему равна нормальность кислоты?
Решение. Как видно из уравнения, растворы взаимодействуют в эквивалентных количествах:
НСl + NаОН = NаСl + Н2О.
При разных нормальностях растворы реагирующих веществ взаимодействуют между собой в объемах, обратно пропорциональных их нормальностям:
 или С1×V1 = C2×V2 , (21)
или С1×V1 = C2×V2 , (21)
где С1, С2 – нормальные концентрации НСl и NаОН соответственно,
V1, V2 – объемы растворов НСl и NаОН.
С1×50 = 25×0,5; С1 =  .
.
ЗАДАЧИ
101.К 1 л 10%-го раствора КОН (r = 1,092 г/мл) прибавили 0,5 л 5%-го раствора КОН (r = 1,045 г/мл). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Ответ: 1,2 М.
102.Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н раствора Н2SO4 прибавить 125 см3 0,2 н раствора КОН .
Ответ: 0,14 г КОН.
103.Для осаждения в виде АgCl всего серебра, содержащегося в 100 см3 раствора АgNО3, потребовалось 50 см3 0,2 н раствора НСl. Чему равна нормальность раствора АgNO3.Сколько граммов АgCl выпало в осадок?
Ответ: 0,1 н; 1,433 г.
104.Какой объем 0,3 н раствора НСl требуется для нейтрализации раствора, содержащего 0,32 г NаОН в 40 см3?
Ответ: 26,6 см3.
105.На нейтрализацию 31 см3 0,16 н раствора щелочи потребуется 217 см3 раствора Н2SO4. Чему равна нормальность раствора кислоты?
Ответ: 0,023 н.
106.Сколько граммов НNO3 содержалось в растворе, если на его нейтрализацию потребовалось 35 см3 0,4 н раствора NаОН?
Ответ: 0,882 г.
107.Определите объем раствора 1,2 М NаОН, который потребуется для полного осаждения железа в виде гидроксида из раствора FеСl3 с массой 300 г с массовой долей соли в нем 12%.
Ответ: 554 мл.
108.1 л 0,5 М раствора едкого натра смешали с 1 л 0,4 н раствора серной кислоты. Сколько молей и какого вещества осталось в избытке?
Ответ: 0,1 моль NаОН.
109.На нейтрализацию 10 мл раствора едкого натра пошло 6 мл 0,5 н раствора НСl. Вычислите нормальность раствора щелочи.
Ответ: 0,3 н.
110.Сколько миллилитров 2 н раствора Nа2СО3 надо прибавить к 50 мл 1,5 н раствора ВаСl2, чтобы полностью осадить барий в виде ВаСО3?
Ответ: 37,5 мл.
111.Смешивают раствор едкого натра, содержащий 8 г NаОН в 1 л, с раствором соляной кислоты, содержащим 24 г НСl в 1 л. В каком объемном соотношении нужно взять растворы, чтобы произошла полная нейтрализация.
Ответ: 3,3 объёма NаОН на 1 объём НСl?
112.Вычислить молярность 20%-го раствора НСl плотностью 1,10 г/мл
Ответ: 6,03 М НСl.
113. Какой объем 20,01%-го раствора НСl (r = 1,100 г/мл) требуется для приготовления 1 л 10,17%-го раствора (r= 1,050 г/мл)?
Ответ: 485,38 см3.
114.Какой объем 50 %-го раствора КОН (r = 1,538 г/мл) требуется для приготовления 3 л 6%-го раствора плотностью 1,048 г/мл?
Ответ: 245,5 мл.
115. Смешали 10 см3 10%-го раствора НNО3 (r = 1,056 г/мл) и 100 см3 30%- го раствора НNО3 (r = 1,184 г/мл). Вычислите процентную концентрацию полученного раствора.
Ответ: 28,38%.
116.Определите массу осадка, который образуется при смешении раствора с массовой долей хлорида бария 5% и раствора с массовой долей сульфата натрия 8% . Масса раствора ВаСl2 равна 15 г, раствора Nа2SO4- 10 г.
Ответ: mВаSO  = 0,84 г.
= 0,84 г.
117. Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массой долей NаNO3 40%, плотность которого 1,32 г/мл?
Ответ: 6,2 моль.
118.Определите массовую долю хлорида кальция в растворе 1,4 М СаСl2, плотность которого равна 1,12 г/мл.
Ответ: 0,139.
119. Какой объем раствора с массовой долей карбоната натрия 0,15 (r= 1,16 г/мл) надо взять для приготовления раствора 0,45 М Nа2СО3 объемом 120 мл?
Ответ: 32,9 мл.
120. К 3л 10 %-го раствора НNO3 плотностью 1,054 г/мл прибавили 5 л 2%-го раствора той же кислоты плотностью 1,009 г/мл. Вычислите процентную и молярную концентрации полученного раствора, объем которого равен 8 л.
Ответ: 5,0%, 0,82 М.
6.2 Растворы электролитов
Электролитами называются вещества, которые при растворении в воде диcсоциируют (распадаются) на ионы и проводят электрический ток. Неорганические кислоты, основания и соли являются электролитами.
Сила электролита характеризуется степенью диссоциации (a), которая показывает отношение числа молекул, продиссоциированных на ионы (Nд), к общему числу молекул электролита в растворе (Nо), и выражается в процентах: 
a =  100%. (22)
100%. (22)
Условно считают электролиты, диссоциированные на 3% и менее (т.е. a £ 3%) – слабыми, а на 30% и более (a ³ 30%) – сильными.
В растворе слабого электролита устанавливается равновесие между недиссоциированными молекулами и продуктами их распада – ионами. Например, в растворе уксусной кислоты:
СН3СООН « СН3СОО- + Н+
Константа такого равновесия выражается через концентрации соответствующих частиц в растворе и называется константой диссоциации КД.:
Кд =  (23)
(23)
Многоосновные кислоты диссоциируют по ступеням, каждая из которых характеризуется своей константой. Например:
Н3ВО3 «Н+ + Н2ВО  К1
К1
Н2ВО  « Н+ + НВО
« Н+ + НВО  К2
К2
НВО  « Н+ + ВО
« Н+ + ВО  К3
К3
Согласно закону разбавления Оствальда, Кд и a связаны уравнением
Кд =  (24)
(24)
где Сэл – молярная концентрация электролита, моль/л.
При a<<1 уравнение упрощается:
Кд = a2×Cэл. (25)
Для расчетов, связанных с диссоциацией кислот, часто используют не Кдис, а показатель константы диссоциации рК, который равен:
рК = -lgКд. (26)
С возрастанием Кд, т.е. с увеличением силы кислоты, значение рК уменьшается, следовательно, чем больше рК, тем слабее кислота. Так, значения рК для слабых кислот от СН3СООН до НСN лежат в пределах от 4,76 до 9,21.
Для одноосновных кислот, например уксусной – СН3СООН, концентрации[Н+ ] и [А-] равны и составляют:
[Н+ ]=[СН3СОО-] = a× Сэл.
С учетом уравнения (25) имеем:
[Н+ ]=[ СН3СОО-]= Сэл × 
 .
.
Пример 1. Степень диссоциации СН3СООН в 0,1М растворе равна 1,32×10-2. Найдите константу диссоциации кислоты и значение рК. По величине рК сделайте вывод о силе кислоты.
Решение. Запишем уравнение диссоциации уксусной кислоты:
СН3СООН« Н+ + СН3СОО–
Подставим данные задачи в уравнение Оствальда:
КД =  =
=  .
.
Откуда рК = -lg КД = -lg(1,77×10-5) = 5- lg1,77 =5-0,25 = 4,75.
Пример 2. Какова концентрация ионов водорода в 0,1 М растворе германиевой кислоты Н2GеО3, если константа диссоциации кислоты по первой ступени равна 2,6×10-9?
Решение. Запишем уравнение диссоциации германиевой кислоты по первой ступени:
Н2GеО3 « Н+ + НGеО 
Сн+ = 
 = 1,61×10-5 г-ион/л.
= 1,61×10-5 г-ион/л.
В насыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
ВаSO4 « Ва2+ + SO 
в осадке в растворе
По закону действующих масс:
Кравн. =  или Кравн×СВаSO
или Кравн×СВаSO  = CВа
= CВа  ×С
×С  ,
,
где Кравн – константа равновесия;
CВа  , С
, С  , СВаSO
, СВаSO  – концентрации катиона, аниона и электролита (в осадке).
– концентрации катиона, аниона и электролита (в осадке).
Концентрация твердой фазы остается неизменной и её условно принимают равной единице, а величину Кравн×СВаSO  называют произведением растворимости и обозначают ПР:
называют произведением растворимости и обозначают ПР:
ПР = Кравн ×С ВаSO  или ПР = CВа
или ПР = CВа  ×С
×С  . (27)
. (27)
Величина ПР является важной термодинамической константой и характеризует равновесие между насыщенным раствором и твердой фазой. С помощью ПР можно решать многие вопросы химической практики.
Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его ПР. Растворение осадка такого электролита происходит, когда произведение концентраций его ионов меньше, чем ПР.
Пример 3. Произведение растворимости Аg2Cr2O7 равно 2,0×10-7.
Вычислить концентрацию ионов Аg+ в насыщенном растворе Аg2Cr2O7, не содержащем одноименных ионов.
Решение. Уравнение диссоциации Аg2Cr2O7 имеет вид:
Аg2Cr2O7 = 2Аg+ + Cr2O 
Поэтому ПР = С  = 2,0×10-7.
= 2,0×10-7.
Так как при диссоциации Аg2Cr2O7 ионов Cr2O  получается в 2 раза меньше, чем ионов Аg+, следовательно:
получается в 2 раза меньше, чем ионов Аg+, следовательно:
Cr2O  =
=  ; C
; C  ×
×  = 2,0×10-7;
= 2,0×10-7;
C  =
=  =
=  = 0,74×10-2 моль/л.
= 0,74×10-2 моль/л.
Пример 4. Установлено, что произведение растворимости ПР равно 5,6×10-16. Выпадает ли осадок при смешивании равных объемов растворов 0,02М МnSO4 и 0,01М (NН4)2S ?
Решение. Запишем уравнение реакции:
МnSO4 + (NН4)2S = МnS¯ + (NН4)2SO4
При смешении двух растворов объем раствора увеличивается вдвое, а концентрации взятых веществ в смеси будут в 2 раза меньше.
Концентрация раствора МnSO  будет равна 0,01 моль/л, а раствора (NН
будет равна 0,01 моль/л, а раствора (NН  )
) 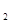 S – 0,005 моль/л.
S – 0,005 моль/л.
СS  = 0,005 г-ион/л, СМn
= 0,005 г-ион/л, СМn  = 0,01 г-ион/л.
= 0,01 г-ион/л.
Отсюда СS  × СМn
× СМn  = 0,01×0,005 = 5×10-5, что больше, чем ПРМnS =5,6×10-16. Следовательно, осадок выпадает.
= 0,01×0,005 = 5×10-5, что больше, чем ПРМnS =5,6×10-16. Следовательно, осадок выпадает.
Водородный показатель – рН
Вода частично диссоциирована:
Н2О « Н+ + ОН–
По закону действующих масс:
 Д; КД. × СН
Д; КД. × СН 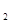 O = Сн
O = Сн  × Сон - = К Н
× Сон - = К Н 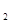 O.
O.
К Н 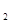 O – ионное произведение воды. На основании опыта установлено, что при t = 250С оно составляет 10-14 (моль/л)2. Тогда для чистой воды:
O – ионное произведение воды. На основании опыта установлено, что при t = 250С оно составляет 10-14 (моль/л)2. Тогда для чистой воды:
К Н 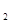 O = 10-14 = Сн
O = 10-14 = Сн  × Сон - ; (28)
× Сон - ; (28)
Сн  = С он - =
= С он - =  = 10-7моль/л .
= 10-7моль/л .
Для удобства расчетов используют водородный показатель рН:
рН = – lg Сн  .
.
рН – величина, характеризующая характер среды. При рН< 7 – кислая среда, т.к. Сн  >> Сон -, при рН = 7- среда нейтральная и Сн
>> Сон -, при рН = 7- среда нейтральная и Сн  = Сон -, при рН >7 – щелочная среда , т.к. Сн
= Сон -, при рН >7 – щелочная среда , т.к. Сн  << Сон -.
<< Сон -.
Из вышеизложенного справедливо уравнение
рН + рОН = 14.
Пример 5. Чему равна концентрация ОН- – ионов в растворе, рН которого равен 10,80?
Решение. Воспользуемся приведенной формулой:
рОН = 14-рН = 14 - 10,80 = 3,20.
- lg[ОН-] = 3,2 ; lg[ОН-] = - 3,20.
По таблице антилогарифмов находим, что [ОН-] = 6,31×10-4 моль/л.

ЗАДАЧИ
121-123. Вычислите константу диссоциации кислот по следующим данным и запишите уравнения диссоциации кислот по всем ступеням.
| № задачи | кислота | Концентрация, моль/л | a (для 1 ступени), % | Ответы |
| Н2СО3 | 0,006 | 0,85 | 4,3×10-7 | |
| Н3РО3 | 0,1 | 1×10-2 | ||
| Н2S | 0,1 | 0,07 | 5×10-8 |
124.Определите концентрацию ОН- - ионов в а) 1М; б) 0,02М растворе NН4ОН. КД основания равно 1,8×10-5.
Ответ: а) 0,4×10-2 г-ион/л; б) 0,6×10-3г-ион/л.
125.Степень диссоциации уксусной кислоты СН3СООН в 1М растворе при 190С равна 0,004. Вычислите концентрацию ионов СН3СОО–, Н+ и общую концентрацию ионов в растворе.
Ответ: 0,004 моль/л; 0,008 моль/л.
126.Вычислите степень электролитической диссоциации 0,05 М раствора НIО3, если константа диссоциации кислоты равна 3×10-5.
Ответ: 2,45×10-2.
127. Вычислите концентрацию ионов водорода в 0,1 М растворе хлорноватистой кислоты НСlО (КД= 5×10-8).
Ответ: 7×10-5моль/л
128.Определите рН и рОН раствора NaOH с концентрацией 0,1 моль/л.
Ответ: 13 и 1.
129. Ступенчатые константы диссоциации Н2S равны К1 = 6 × 10-8,
К2 =1×10-14. Вычислите константу полной диссоциации и концентрации ионов Н+, НS-, S2- в 0,1 М растворе сероводородной кислоты.
Ответ: 7,7×10-5моль/л, 1×10-14моль/л.
130-134.Вычислите произведение растворимости вещества (ПР) по данным о его растворимости в воде.
| № задачи | Вещество | Растворимость, моль/л | Ответы |
| ВаС2О4 | 4,03×10-4 | 1,62×10-7 | |
| Аg2СО3 | 1,15×10-4 | 6,15×10-12 | |
| ВаСО3 | 8,40×10-5 | 7,05×10-9 | |
| Аg2SО4 | 2,68×10-2 | 7,70×10-5 | |
| Вi(IО3)3 | 2,80×10-4 | 1,66×10-13 |
135-139.Выпадет ли осадок при сливании равных объемов растворов 1 и 2 с концентрацией С, моль/л? Напишите уравнения реакций.
| № задачи | Растворы | Осадки | ПР | |||
| С1 | С2 | |||||
| СаСl2 | 0,02 | Nа2SО4 | 0,02 | СаSО4 | 1,0×10-5 | |
| LаСl3 | 0,02 | NаОН | 0,03 | Lа(ОН)3 | 5×10-21 | |
| Sr(NО3)2 | 0,002 | К2SО4 | 0,002 | SrSO4 | 3,6×10-7 | |
| СuSO4 | 0,01 | (NН4)2S | 0,02 | СuS | 4×10-38 | |
| АgNO3 | 0,02 | Н2SO4 | Аg2SO4 | 2×10-5 |
140.Вычислите концентрацию [Н+] в растворах, в которых концентрация [ОН-] – ионов (в моль/л) составляет:
а) 10-4 , б) 3,2×10-6 , в) 7,4×10-11.
Ответы: а) 10-10моль/л, б) 3,12×10-9 моль/л, в) 1,35×10-4моль/л.
7 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными реакциями называются реакции, в результате которых изменяются степени окисления элементов.
Степени окисления определяются числом электронов, передаваемых от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. Например, в молекуле NаСl менее электроотрицательным является атом натрия, более электроотрицательным – атом Сl, поэтому электроны смещаются в сторону атома хлора. Натрий приобретает степень окисления +1, а хлор -1.
Процесс присоединения электронов частицами (атомами, ионами, молекулами) называется их восстановлением, а вещество, содержащее такую частицу, является окислителем.
Процесс отдачи электронов – окисление, а вещество – восстановитель. Следует также учесть, что если атомы окислителя и восстановителя содержатся в одной и той же молекуле, то реакция называется реакцией внутримолекулярного окисления – восстановления. Например:
2КСlО3 = 2 КCl +3О2
Если же в таких реакциях окислителем и восстановителем являются атомы одного и того же элемента, то окислительно-восстановительный процесс называется диспропорционированием. Например, в реакции:
3К2МnО4 + 2Н2О = 2КМnО4 + МnО2¯ + 4КОН
Mn+6 диспропорционирует в Mn+7 и в Мn+4.
Имеют место и реакции обратного диспропорционирования, в которых атомы, находящиеся в различных степенях окисления, приобретают одинаковую окисленность (степень окисления), например:
NH4NO3 = N2О + 2H2O
где N-3, окисляясь, а N+5 , восстанавливаясь, переходят в N+1.
Типичными окислителями являются : F2, О2, Сl2, перманганат-ион MnО  , дихромат-ион Cr2O
, дихромат-ион Cr2O  , диоксид свинца РbО2. Типичными восстановителями являются: активные металлы (К, Nа, Са), углерод (С), сульфид-ион(S-2), иодид-ион (I–), сульфит-ион (SO
, диоксид свинца РbО2. Типичными восстановителями являются: активные металлы (К, Nа, Са), углерод (С), сульфид-ион(S-2), иодид-ион (I–), сульфит-ион (SO  ), Fе2+, Sn2+ и др.
), Fе2+, Sn2+ и др.
В простых веществах О2, Cl2, Н2, N2 и др. оба атома имеют одинаковую электроотрицательность. При образовании из этих атомов молекул смещения электронов не происходит, поэтому степень окисления в простых веществах равна нулю. Некоторые простые вещества, например Fе, S, С и другие могут иметь разную степень окисления. Так, железо может иметь степень окисления +2 и +3, медь – +1 и +2, сера – +2, +4, +6. Кислород, как правило, имеет степень окисления –2, но в пероксидах его степень окисления равна (–1), во фторидах (+2). Постоянную степень окисления имеют щелочные металлы (+1), элементы II группы – (+2), алюминий – (+3), галоген-ионы – (-1).
В зависимости от того, к какому атому больше смещена электронная пара, говорят о положительной или отрицательной степени окисления. Степень окисления элемента, ближе к которому смещена электронная пара, является отрицательной, тогда как степень окисления другого атома в молекуле – положительна. Например, в молекуле воды электронная пара смещена в сторону атома кислорода. Следовательно, атом кислорода проявляет отрицательную степень окисления, а атомы водорода положительную.
В связи с тем что молекула в целом электронейтральна, то количество всех отрицательных единиц степени окисления должно быть равно количеству положительных единиц.
Положительная степень окисления, как правило, присуща тем элементам, которые на внешнем энергетическом уровне имеют 1, 2, 3 электрона, и, чтобы создать устойчивую 8-электронную оболочку, им легче отдать эти электроны, чем присоединить 7, 6, 5 электронов соответственно. Поэтому эти атомы будут отталкивать электроны.
Отрицательную по знаку степень окисления, как правило, будут иметь те элементы, у которых на внешнем энергетическом уровне 5, 6, 7 электронов, и для создания 8-электронного энергетического уровня им легче принять недостающие, чем отдать 5, 6, 7 электронов. Эти атомы будут притягивать электроны.
Знание знака и величины степени окисления атомов с постоянным значением позволяет вычислить степени окисления других атомов в сложных соединениях.
Пример 1. Определить степень окисления серы в серной кислоте Н2SO4.
Решение. Для определения степени окисления серы в серной кислоте вспомним, что атом кислорода имеет степень окисления (-2), а атом водорода (+1). В целом молекула любого вещества электронейтральна, следовательно, 2×(+1) + х + (-2)×4 = 0. Отсюда сера в серной кислоте имеет степень окисления +6.
Пример 2. Определить степень окисления марганца в перманганате калия КМnO4.
Решение. Степень окисления кислорода –2, калия +1. Молекула КМnO4 электронейтральна, следовательно: (+1)×1 + х + 4×(-2)=0.
Степень окисления марганца в перманганате калия равна +7.
Подбор коэффициентов в окислительно-восстановительных реакциях
При подборе коэффициентов в уравнениях окислительно-восстановительных реакций пользуются двумя методами: электронного баланса и ионно-электронного баланса. Остановимся на первом.
Для успешной расстановки коэффициентов в окислительно-восстановительных уравнениях важно соблюдать следующую последовательность:
1 Записать уравнение реакции, отметить элементы, изменяющие в результате реакции свои степени окисления, найти окислитель и восстановитель.
2 Составить схемы полуреакций окисления и восстановления с указанием исходных и образующихся частиц.
3 Уравнять число частиц каждого элемента в левой и правой частях полуреакций.
4 Уравнять суммарное число зарядов в левой и правой частях каждой полуреакции; для этого прибавить или отнять в левой части полуреакций необходимое число электронов.
5 Подобрать множители для полуреакций так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
6 Сложить уравнения полуреакций с учетом найденных коэффициентов.
7 Расставить коэффициенты в уравнении реакции и проверить правильность расстановки. Число частиц каждого элемента в правой части уравнения должно быть равно числу частиц в левой части.
Рассмотрим применение метода электронного баланса в окислительно-восстановительных реакциях на нескольких примерах.
Пример 3.
К2 

Решение. Определим степень окисления всех элементов и установим, у каких из них она меняется. В молекуле К2Сr2O7 ионы кислорода имеют суммарный электрический заряд, равный (–2)×7 = -14. Молекула электронейтральна. Заряд двух ионов калия равен +2, а два иона хрома имеют заряд +12, следовательно, на долю одного иона хрома приходится +6 зарядов.
В правой части уравнения в молекуле Сr2(SO4)3 хром связан с кислотным остатком серной кислоты, имеющим заряд –2. Молекула электронейтральна, следовательно, два иона хрома должны быть связаны с тремя SО  – ионами. Рассуждая таким же образом, приходим к выводу, что степень окисления серы в сульфите натрия Nа2SO3 равна +4, а в сульфате натрия Nа2SO4 +6.
– ионами. Рассуждая таким же образом, приходим к выводу, что степень окисления серы в сульфите натрия Nа2SO3 равна +4, а в сульфате натрия Nа2SO4 +6.
Составим электронные уравнения и приводим к балансу количество отданных и принятых электронов (окислителя и восстановителя). С учетом коэффициентов складываем ионы левых и правых частей полуреакций.


 2Сr+6 + 6ē ® 2Сr+3 2 1 восстановление, окислитель
2Сr+6 + 6ē ® 2Сr+3 2 1 восстановление, окислитель
S+4 - 2ē ® S+6 6 3 окисление, восстановитель
2Сr+6+ 3S+4®2Cr+3 +3S+6
Полученные коэффициенты переносим в молекулярное уравнение, причем коэффициент для хрома не удваиваем, чтобы сохранить его баланс в левой и правой частях уравнения.
Приводим к балансу ионы калия и натрия.
Подсчитываем количество кислотных остатков справа и вычитаем три кислотных остатка в составе Nа2SO3, участвующих в окислении. Разница в коэффициентах дает коэффициент для кислоты.
Уравниваем водород в составе молекулы воды.
Проверку правильности расстановки коэффициентов проводим по количеству атомов кислорода. В левой и правой частях уравнения оно равно 32.
Окончательное уравнение реакции: К2Сr  .
.
Пример 4. 
Решение. Определяем степень окисления всех элементов и устанавливаем, что они меняются у марганца и хлора.
Составляем электронные уравнения и приводим к балансу ионы окислителя и восстановителя. С учетом коэффициентов складываем ионы левой и правой частей уравнений: 



 6 3 окисление, восстановитель
6 3 окисление, восстановитель
Сl+5 + 6ē ®Сl- 3 1 восстановление, окислитель
3Мn+4 + Cl+5 ® 3Мn+7 + Cl–
Коэффициенты краткого уравнения переносим в молекулярное уравнение, затем приводим к балансу коэффициенты других ионов.
Проверку правильности расстановки коэффициентов проводим по кислороду. В левой и правой части уравнения количество атомов кислорода равно 15.
3 МnO2 + КСlO3 + 6КОН ® 3К2МnO4 + КСl + 3Н2О
ЗАДАЧИ
Расставьте коэффициенты в уравнениях окислительно-восстановительных реакций. Укажите окислитель и восстановитель.
141.МnSO4 + КМnO4 + Н2О ® МnO2 + К2SO4 + Н2SO4
142.FеSO4 + КClO3 + Н2SO4 ® Fе2(SO4)3 + КСl + Н2О
143.КIО3 + КI + Н2SO4 ® I2 + К2SO4 + Н2О
144.I2 + Сl2 + Н2О ® НIО3 + НСl
145.NаСrO2 + Вr2 + NаОН ® Nа2СrO4 + NаВr + Н2О
146.Р + НClO3 + Н2О ® Н3РО4 + НСl
147.РbS + НNO3 ® S + Рb(NO3)2 + NO + Н2О
148.КВr + РbО2 + НNO3 ® Рb(NO3)2 + Вr2 + КNO3 +Н2О
149.Sb2O3 + НВrO3 ® Sb2O5 + НВr
150.Сr2O3 + КNО3 + КОН ® К2СrO4 + КNO2 + Н2О
151.Н2S + Cl2 + Н2О ® Н2SO4 + НСl
152.Nа2МnO4 + NаNO2 + Н2О ® МnO2 + NаNO3 + NаОН
153.КМnО4 + НСl ® МnСl2 + КCl + Сl2 + Н2O
154.Н2SO3 + К2Сr2О7 + Н2SO4 ® Cr2 (SO4)3 + К2SO4 + Н2О
155.FеSO4 + КМnO4 + Н2SO4 ® Fе2(SO4)3 + МnSO4 + Н2О + К2SO4
156.NаBr + MnO2 + Н2SO4 ® МnSO4 + Nа2SO4 + Br2 + Н2О
157.Мg + Н2SO4 ® МgSO4+ S+ Н2О
158.Н2SO3 + Cl2 + Н2О ® Н2SO4 + НСl
159.Н2S + НNO3 ® S + NO2 + Н2О
160.КNО3 + КI + Н2SO4 ® NO + I2 + К2SO4+ Н2О
Гальванические элементы
Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительных реакций непосредственно преобразуетсяв электрическую. При этом процессы окисления и восстановления пространственно разделены, а перенос электронов осуществляется через внешнюю цепь.
Окислительно-восстановительные реакции протекают на электродах - системах, состоящих из металлов, погруженных в раствор или расплав электролита. Между металлической фазой электрода и раствором в приэлектродном пространстве происходит непрерывный обмен ионами, молекулами и электронами. В результате перераспределения зарядов на границе металл-раствор возникает двойной электрический слой, характеризуемый скачком потенциала.
Разность потенциалов между металлом и раствором называется электродным потенциалом. Состоянию электродного равновесия соответствует равновесный электродный потенциал. Все факторы, влияющие на химическое равновесие (природа металла, растворителя, концентрация, температура), определяют и величину электродного потенциала.
Стандартным электродным потенциалом (j0) называют потенциал металла, погруженного в раствор своей соли с концентрацией ионов 1 моль/л при температуре 298 К и давлении Р = 1,01325·105 Па. Ряд стандартных потенциалов (табл. 6) позволяет дать количественную характеристику электрохимической активности металлов. Чем меньше значение j0, тем больше восстановительные свойства металла.
Для вычисления значения электродного потенциала в условиях, отличных от стандартных, пользуются уравнением Нернста:
j = j0 +  (29)
(29)
где Т - температура, К;
F – число Фарадея, равное 96500 Кл/моль;
R – универсальная газовая постоянная, равная 8,314 Дж/моль·К;
n – число электронов, принимающих участие в процессе;
 –концентрация ионов металла в растворе, моль/л.
–концентрация ионов металла в растворе, моль/л.
Формулу Нернста можно упростить, приняв значение Т=298 К:
j = j0+  .(30)
.(30)
Если два электрода соединить проводником, а растворы электрическим ключом, то образуется гальванический элемент (рис. 2).
Анодом является металл с меньшим электродным потенциалом (jА<jk), и на нем происходит процесс окисления:
 А MeA – m
А MeA – m  = Me
= Me  (31)
(31)
При этом растворяется металлический электрод.
На катоде происходит процесс восстановления катионов электролита (если jме > -1,4 B):
 K Me
K Me  +n
+n  = Me
= Me  (32)
(32)
Если j ме< -1,4B,то на катоде восстанавливается вода:
 K 2H2O + 2
K 2H2O + 2  = H2 + 2OH- (33)
= H2 + 2OH- (33)
Символическая запись (схема) гальванического элемента имеет вид:

 А
А К , если jА< jК.
К , если jА< jК.
Таблица 5
