Концентрации компонентов раствора
Общие представления. Способы выражения
концентрации компонентов раствора
Раствором называется однородная смесь двух и более веществ. Раствор – это однофазная система, состав которой может изменяться в определённых пределах или это фаза переменного состава. Составляющие раствор вещества называются компонентами. Компонент, содержание которого велико принято называть растворителем. Остальные компонент, которые присутствуют в растворе в меньших количествах, называют растворёнными веществами. Деление компонентов раствора на растворитель и растворённое вещество является условным, особенно в случае, если количества компонентов раствора соизмеримы. С термодинамической точки зрения все компоненты раствора равноценны.
Различают растворы газообразные, жидкие и твёрдые. Газообразные растворы обычно представляют собой смесь газов.
Под жидкими растворами понимают растворы, полученные смешением жидкостей, растворением твёрдых веществ или газов в жидкостях, плавлением твёрдых систем, содержащих два и более компонентов. Наиболее широкое распространение получили жидкие растворы, в которых в качестве растворителя служит вода.
Твёрдые растворы делятся на растворы замещения, внедрения и вычитания. Растворы замещения образуются на основе кристаллической решётки растворителя, в узлах которой атомы растворителя замещаются атомами растворённого вещества. Такие растворы обычно образуют вещества с близкими кристаллохимическими свойствами. Растворы замещения имеют наибольшее распространение в природе. Растворы внедрения образуются за счёт внедрения в междоузлия кристаллической решётки растворителя атомов растворённого вещества. Такие растворы обычно образуются при растворении в металлах неметаллов, каких как водород, кислород, углерод, бор, кремний и др. Твёрдые растворы вычитания образуются при выпадении из кристаллической решётки вещества некоторых атомов. Иногда твёрдые растворы вычитания называют твёрдыми растворами с дефектной решёткой. Такие растворы встречаются относительно редко. Важнейшей характеристикой раствора является его состав, который характеризуется концентрацией компонентов. Концентрация компонентов раствора может быть выражена различными способами.
1) Весовая (массовая) доля:
wi = 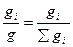 , (7.1)
, (7.1)
где wi – весовая(массовая) доля i – го компонента;
gi - масса i – го компонента в растворе;
g = Σgi – масса всего раствора.
Сумма массовых долей всех компонентов раствора равна единице:
Σwi = 1 (7.2)
2) Весовой (массовый) процент:
pi(мас)= 100wi, (7.3)
где pi(мас) – весовой(массовый) процент i – го компонента в растворе.
Очевидно, что
Σp(мас)i = 100 (7.4)
3) Молярная доля:
xi = 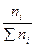 , (7.5)
, (7.5)
где xi – молярная доля i – компонента;
ni – число молей i – го компонента в растворе;
Σni – общее число молей всех компонентов в растворе.
Сумма молярных долей всех компонентов в растворе равна единице:
Σxi = 1 (7.6)
4) Молярный процент:
рi(мол) = 100xi , (7.7)
где pi(мол) – молярный процент i – го компонента в растворе.
Очевидно, что
Σpi(мол) = 100 (7.8)
5) Молярность – число молей i – го компонента в 1л раствора.
Сi = 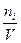 , (7.9)
, (7.9)
где Сi – молярная концентрация i – го компонента в растворе , 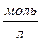 ;
;
V – объём раствора, л;
ni – число молей i – го компонента в растворе, моль.
6) Моляльность - число молей i – го компонента, приходящегося на 1000 г
растворителя (воды):
bi = 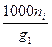 , (7.10)
, (7.10)
где bi – моляльная концентрация i – го компонента в растворе, 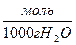 ;
;
g1 – масса растворителя, г;
ni – число молей i – го компонента, растворённого в g1 граммах
растворителя.
