Растворение металлов под током в коррозйонноактивных средах
Скорость коррозии металлов может быть определена из поляризационных кривых в коррозионноактивнои среде. Катодная поляризационная кривая, полученная, например, на цинке в слабокислом растворе при достаточно высоких поляризациях, будет соответствовать реакции восстановления ионов гидроксония, а анодная — растворению цинка (рис. 14.4, кривые 1 и 2).
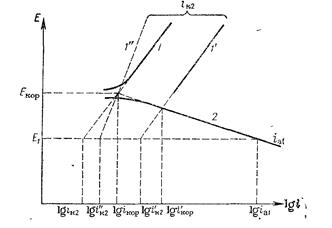
Рис. 14.4. Катодные поляризационные кривые выделения водорода (1, 1’, 1’’) и анодная кривая (2) ионизации металла на металлическом электроде в отсутствие ионов металла в растворе.
Экстраполяция тафелевских участков поляризационных кривых, каждая из которых соответствует одной из сопряженных реакций, до пересечения дает значения коррозионного потенциала Екор и тока коррозии lg iкор.
Небольшой сдвиг от коррозионного потенциала (ΔЕ) в отрицательную сторону вызывает ускорение процесса выделения водорода и замедление реакции ионизации цинка. В результате в цепи будет протекать ток:
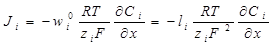
или
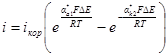
Разложим экспоненты в ряд и ограничимся двумя первыми членами разложения
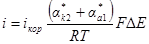
откуда
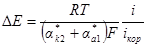
Из этого уравнения видно, что чем больше плотность тока коррозии, тем меньше сдвиг потенциала от значения коррозионного потенциала при заданном значении катодной плотности тока. Обозначим:
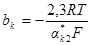 ;
; 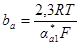
Тогда
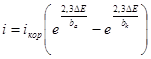
откуда для малых ΔЕ
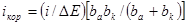
Метод, основанный на определении токов коррозии по последнему уравнению, называется методом поляризационного сопротивления. Для расчета тока коррозии снимают поляризационную кривую в области небольших отклонений от коррозионного потенциала и находят i/ΔE. Величины bк и ba обычно бывают известны либо определяются из поляризационных кривых при больших поляризациях.
Из рассмотрения поляризационных кривых следует, что увеличение анодной поляризации приводит к росту анодного тока растворения металла. Так, при потенциале Е1 (см. рис. 14.4) анодный ток растворения цинка (lg ia1) значительно превышает ток коррозии, а ток выделения водорода (lg ik2) уменьшается и, следовательно, истинное значение тока коррозии цинка при анодном потенциале снижается. Падение тока коррозии при анодной поляризации корродирующего металла называется положитель-ным разностным эффектом (положительным дифференц-эффек-том). Чем больше наклон катодной поляризационной кривой (кривая 1’’ на рис. 14.4), тем меньше снижение скорости выделения водорода и тока коррозионного растворения цинка.
В ряде случаев, например при растворении магния и алюминия в растворах, содержащих хлорид-ионы, наблюдается противоположное явление — увеличение скорости выделения водорода при анодной поляризации металла, т. е. отрицательный разностный эффект (отрицательный дифференц-эффект).
Причиной отрицательного разностного эффекта может быть образование ионов промежуточной валентности при растворении металла, которые затем, окисляясь, восстанавливают воду или ионы гидроксония до водорода. Второй причиной увеличения скорости выделения водорода может быть существование на поверхности металлов оксидных или других пленок (адсорбционных), которые отрываются при интенсивном растворении металла. В результате удаления пленки на чистой поверхности перенапряжение выделения водорода снижается, что вызывает сдвиг катодной поляризационной кривой в положительную сторону (рис. 14.4, кривая 1’). Как видно из рисунка, ток выделения водорода при этом возрастает (lg i’к2) по сравнению с металлом, не покрытым оксидной пленкой (lg iк2), но остается ниже тока коррозии на свежем металле (lg i’кор). В пользу существования пленок на алюминии указывает тот факт, что при растворении алюминия и магния в щелочных растворах отрицательный разностный эффект отсутствует.
Я. М. Колотыркин и Г. М. Флорианович высказали мысль о том, что отрицательный разностный эффект может быть вызван изменением кислотности прианодного слоя. Действительно, В. В. Сысоева, И. А. Черепкова и Г. Л. Барунина методом микростеклянного электрода установили, что при анодной поляризации алюминия в 3%-ном растворе NaCl происходит подкислеиие при-анодного слоя. Парциальная поляризационная кривая выделения водорода, построенная с учетом изменения рНs, принимает нормальный вид, т. е. скорость выделения водорода возрастает вместе со сдвигом потенциала в электроотрицательную сторону. Однако парциальная поляризационная кривая выделения водорода не совпадает с поляризационной кривой выделения водорода при катодной поляризации (рис. 14.5). Следовательно, хотя изменение рН прианодного слоя и играет определенную роль в отрицательном дифференц-эффекте, но не объясняет целиком причину его возникновения. По-видимому, отрицательный дифференц-эффект возникает как следствие влияния на кинетику процессов одновременно нескольких из указанных выше факторов.
При катодной поляризации электрода в коррозионноактивной среде наблюдаются явления, аналогичные рассмотренным: обычно происходит лишь уменьшение скорости ионизации металла. Этот эффект носит название протект-эффекта.
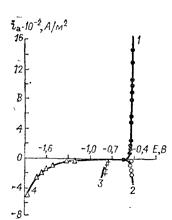
Рис. 14.5. Анодные и катодные поляризационные кривые на алюминиевом электроде:
1 — парциальная кривая растворения алюминия, практически совпадающая с общей анодной поляризационной кривой; 2 — парциальная кривая выделения водорода; 3 — то же с учетом pHs (расчет); 4 — катодная поляризационная кривая выделения водорода на предварительно аноднополяризованном алюминии.
Появление дифференц- и протект-эффектов происходит не только при сдвиге потенциала от внешнего источника тока, но и при контакте корродирующего металла с другим металлом. Так, положительный дифференц-эффект на цинке легко обнаружить, измеряя скорость выделения водорода на чистом цинке и при его контакте с платиной. При контакте цинка с платиной количество выделяющегося на цинке водорода меньше, чем на цинке при коррозионном потенциале. Если же привести в соприкосновение железный и цинковый электроды, погруженные в морскую воду, то происходит сдвиг потенциала железа в катодную сторону и снижение скорости коррозии благодаря протект-зффекту.
