Кинетика химических реакций
Цель работы: изучение скорости химической реакции и её зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры.
Теоретическое введение
Привести понятия средней и истинной скоростей химической реакции; факторы, определяющие скорость химической реакции; закон действующих масс, закон Вант-Гоффа.
Экспериментальная часть
Опыт 1. Изучение влияния концентрации соли на скорость реакции тиосульфата натрия с серной кислотой.
Сильная серная кислота вытесняет слабую тиосерную кислоту из тиосульфата натрия:
Na2S2O3 +H2SO4= H2S2O3 + Na2SO4.
Тиосерная кислота в свободном состоянии неустойчива и распадается:
Н2S2O3 =SO2 + H2O + S¯.
Образование свободной серы наблюдается визуально по помутнению прозрачного раствора.
Суммарное уравнение реакции имеет следующий вид:
Na2S2O3 +H2SO4= Na2SO4+SO2 +H2O +S¯.
Промежуток времени от момента сливания растворов реагентов до момента начала помутнения раствора пропорционален скорости реакции.
Внесите 0,5М раствор тиосульфата натрия и дистиллированную воду в три пробирки и перемешайте:
в 1-ю пробирку внесите 4 капли раствора Na2S2O3 и 8 капель Н2О;
во 2-ю пробирку – 8 капель раствора Na2S2O3 и 4 капли Н2О;
в 3-ю пробирку – 12 капель раствора Na2S2O3.
Таким образом, в каждой пробирке должно находиться по 12 капель раствора тиосульфата натрия. Если относительную концентрацию соли (сотн) в 1-й пробирке принять равной 1 (4 капли раствора соли), то во 2-й пробирке концентрация составит 2 (8 капель) и в 3-й – 3 (12 капель).
В первую пробирку добавьте 1 каплю 1н раствора серной кислоты с концентрацией и встряхните содержимое. С помощью секундомера измерьте время от попадания капли кислоты в раствор соли до появления помутнения (τ,с). Проделайте поочерёдно то же самое со 2-й и 3-й пробирками.
Экспериментальные данные занесите в табл. 4.1. Рассчитайте относительную скорость реакции:
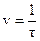 .
.
Таблица 4.1. Экспериментальные данные
| Номер пробирки | Число капель реагентов | сотн Na2S2O3 | τ,с | Относительная скорость реакции, v=1/t,с-1 | ||
| Na2S2O3 | H2O | H2SO4 | ||||
Постройте на миллиметровой бумаге график зависимости 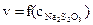 , отложив по оси абсцисс значение относительных концентраций тиосульфата натрия, а по оси ординат – значения соответствующих относительных скоростей реакции.
, отложив по оси абсцисс значение относительных концентраций тиосульфата натрия, а по оси ординат – значения соответствующих относительных скоростей реакции.
Концентрация серной кислоты в опыте постоянна, следовательно, кинетическое уравнение будет иметь вид
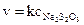 ,
,
а график будет прямой линией, выходящей из начала координат под углом a к оси абсцисс (рис. 4.5.)
Рассчитайте относительную константу скорости реакции из полученного графика по формуле
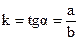 .
.
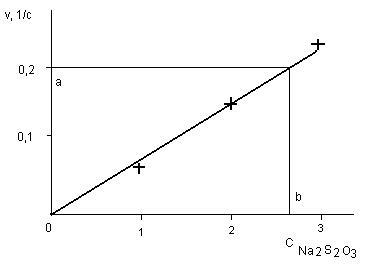
Рис. 4.5. Зависимость относительной скорости реакции от относительной концентрации тиосульфата натрия
Выводы.Отметьте зависимость скорости реакции от концентрации. Укажите возможные источники погрешности опыта.
Опыт 2. Изучение влияния температуры на скорость реакции тиосульфата натрия с серной кислотой.
В опыте 2 исследуется влияние температуры на скорость реакции, описанной в опыте 1.
Поместите в термостат 2 пробирки: одну – с 4 каплями 0,5М раствора Na2S2O3 и 8 каплями дистиллированной воды (перед погружением в термостат пробирку встряхните, чтобы перемешать раствор), другую – с 8 каплями 1М раствора H2SO4. Измерьте температуру (t1). Выдержите растворы при данной температуре, после чего, не вынимая пробирки из термостата, добавьте к раствору тиосульфата натрия 1 каплю раствора Н2SO4. Измерьте время от момента добавления кислоты до начала помутнения раствора.
Повторите опыт при температурах (t1+10 0С) и (t1 +20 0С), нагревая термостат с реактивами на электрической плитке. Результаты опытов занесите в табл. 4.2.
Таблица 4.2.Экспериментальные данные
| Номер опыта | t, oC | Время реакции, τ, с | Относительная скорость v=1/τ, c-1 | Термичский коэффицент скорости γ |
| t1 | ||||
| t1+100С | ||||
| t1+200С |
Рассчитайте температурные коэффициенты скорости реакции:

Постройте на миллиметровой бумаге график зависимости v=f(t), отложив по оси абсцисс температуру, а по оси ординат – относительную скорость реакции, имея в виду, что зависимость является степенной (рис. 4.6).

Рис. 4.6. Зависимость относительной скорости реакции от температуры
Выводы.Отметьте зависимость скорости реакции от температуры. Укажите возможные источники погрешности опыта.
Контрольные вопросы
1. Напишите математическое выражение закона действия масс для реакций:
α) N2O4(г)=2NO(г);
б) 2NO(г)+Br2(г)=2NOBr(г);
в) С(т)+О2(г)=СО2(г).
2. Что называется энергией активации реакции?
Химическое равновесие
Рабочая программа. Химическое равновесие. Константа химического равновесия, Кс, Кр. Константа химического равновесия и изменение энергии Гиббса химической реакции. Смещение химического равновесия. Принцип Лё Шателье. Способы смещения химических равновесий.
Рассмотрим обратимую химическую реакцию между йодом и водородом:
 .
.
Скорости прямой и обратной реакций определяются соотношениями
 ;
;
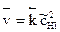 ,
,
где 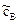 – текущая (неравновесная) концентрация реагента.
– текущая (неравновесная) концентрация реагента.
В начальный момент времени скорость прямой реакции определяется начальной концентрацией йода и водорода, а скорость обратной реакции равна нулю, т.к. начальная концентрация йодида водорода также равна нулю. По мере расходования йода и водорода и образования йодида водорода скорость прямой реакции уменьшается, а скорость обратной реакции растет. Изменение концентраций реагентов в ходе реакции показано на рис. 4.7.
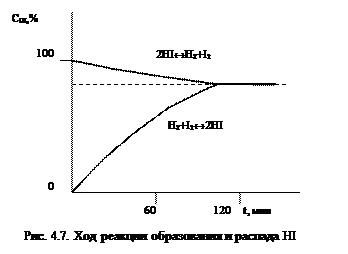
Из рис. 4.7 следует, что, начиная с некоторого момента, состав реакционной смеси перестает изменяться. Это отвечает равенству скоростей прямой и обратной реакций:
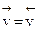 , или
, или 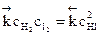 , или
, или 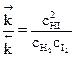 ,
,
где сВ – равновесная концентрация реагента.
Такое состояние реагирующей системы называется химическим равновесием. Состояние химического равновесия устойчиво и может сохраняться неограниченно долго при постоянных внешних условиях. Это не означает прекращения реакций. В состоянии химического равновесия прямая и обратная реакции протекают с равными скоростями, следовательно, химическое равновесие является динамическим равновесием.
Отношение констант скоростей прямой и обратной реак-
ций является также величиной постоянной и носит название константы химического равновесия:
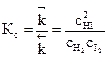 .
.
Величина константы химического равновесия зависит только от природы реагирующих веществ и температуры. Катализатор не влияет на величину константы химического равновесия. Он лишь ускоряет достижение состояния химического равновесия.
Для обратимой реакции, записанной в общем виде
аА + bB ↔ dD + eE,
константа химического равновесия, выраженная через молярные концентрации, запишется следующим образом:
 . (4.12)
. (4.12)
Концентрации реагирующих веществ могут быть выражены различными способами, например через парциальные давления. В этом случае константа равновесия реакции в общем виде будет выглядеть так:
 . (4.13)
. (4.13)
Отметим, что константа равновесия гетерогенных реакций не включает концентрации твердых веществ. Например, константа равновесия реакции термического разложения карбоната кальция
СаСО3(т ) = СаО(т) + СО2(г)
запишется как
 .
.
Пример 4.6.В системе А(г) + 2В(г) ↔ С(г) равновесие установилось при следующих концентрациях веществ: сА = =0,06 моль/л; сВ=0,12 моль/л; сС = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение. Константа равновесия данной реакции выражается уравнением

Подставляя в него данные задачи, получим
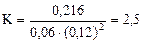 .
.
Для нахождения исходных концентраций веществ А и В учтем, что согласно уравнению реакции из 1 моль А и 2 моль В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль вещества С, то при этом было израсходовано 0,216 моль А и 0,432 моль В (0,216×2 = =0,432).Таким образом, исходные концентрации А и В равны:
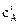 = 0,06 + 0,216 = 0,276 моль/л;
= 0,06 + 0,216 = 0,276 моль/л;  = 0,12 + 0,432 =0,552 моль/л.
= 0,12 + 0,432 =0,552 моль/л.
Пример 4.7.При некоторой температуре константа диссоциации йодида водорода на простые вещества равна 6,25×10-2. Какой процент HI диссоциирует при этой температуре?
Решение. Уравнение реакции диссоциации HI имеет вид
2HI ↔ H2 + I2.
Обозначим начальную концентрацию HI через 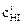 (моль/л). Если к моменту наступления равновесия из каждых
(моль/л). Если к моменту наступления равновесия из каждых 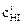 моль HI продиссоциировало xмоль, то при этом согласно уравнению реакции образовалось 0,5xмоль Н2 и 0,5xмоль I2.
моль HI продиссоциировало xмоль, то при этом согласно уравнению реакции образовалось 0,5xмоль Н2 и 0,5xмоль I2.
Таким образом, равновесные (конечные) концентрации составляют
 моль/л и
моль/л и 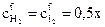 моль/л.
моль/л.
Подставим эти значения в выражение константы равновесия реакции:
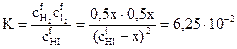 .
.
Решая уравнение, получим x = 0,333С.
Значит, к моменту наступления равновесия продиссоциировало 33,3 % исходного количества иодида водорода.
Константа химического равновесия связана с изменением энергии Гиббса химической реакции простым соотношением
ΔrGo = -RTlnK=-19,14ТlgK. (4.14)
Из (4.14) следует, что, если
ΔrGo <0 , то K>1;
ΔrGo = 0, то K=1;
ΔrGo >0, то K<1.
Константа химического равновесия может быть рассчитана по величине изменения энергии Гиббса реакции:
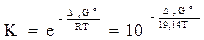 . (4.15)
. (4.15)
Смещение химического равновесия. Принцип Лё Шателье. Состояние химического равновесия сохраняется неограниченно долго при неизменных внешних условиях. Любое изменение условий химического равновесия (Т, р, с) приводит к изменению положения равновесия, т.е. установлению нового равновесия. Направление смещения равновесия определяется принципом Лё Шателье: любое изменение одного из условий химического равновесия (температуры, давления, концентрации) приводит к смещению равновесия в направлении реакции, протекание которой уменьшает эффект произведенного изменения.
1) Влияние температуры. Повышение температуры смещает положение равновесия в сторону эндотермической реакции, а понижение – в сторону экзотермического процесса.
2) Влияние давления. Давление влияет на положение равновесия реакций, протекающих с участием газообразных веществ. Увеличение давления смещает положение равновесия реакции в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. При уменьшении давления равновесие смещается в сторону увеличения числа молей газообразных веществ, т.е. в сторону увеличения давления.
Изменение объёма реакционной системы также влияет на положение равновесия. Увеличение объёма реакционной системы с участием газов ведёт к снижению давления и смещает равновесие в сторону образования большего числа молей газообразных веществ, т.е. в сторону увеличения давления. Уменьшение объёма ведёт к росту давления и смещает положение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления.
3) Влияние концентрации. Увеличение концентрации одного из реагирующих веществ смещает равновесие в сторону реакции, ведущей к его связыванию, и, наоборот, уменьшение концентрации вещества смещает равновесие в сторону процесса образования этого соединения.
Пример 4.8.В каком направлении сместится равновесие реакции
С(тв) + СО2(г) ↔ 2СО(г); ΔrH=119,8 кДж
при а) увеличении температуры; б) увеличении концентрации СО; в) уменьшении давления: г) уменьшении объёма системы?
Решение. а) Прямая реакция является эндотермической, следовательно, увеличение температуры сместит равновесие в сторону прямой реакции, т.е. реакции образования СО.
б) Увеличение концентрации СО сместит положение равновесия в сторону обратной реакции, результатом чего будет уменьшение концентрации СО.
в) Уменьшение общего давления в системе приведет к смещению положения равновесия в сторону прямой реакции, результатом чего будет увеличение давления вследствие образования 2 моль газообразного СО из 1 моль углекислого газа СО2. Наличие твердого углерода на положение равновесия не влияет.
г) Уменьшение объёма системы эквивалентно увеличению давления. Следовательно, положение равновесия сместится в сторону обратной реакции, что прведёт к дополнительному образованию углекислого газа и снижению общего давления.
Вопросы и задачи для самостоятельной подготовки
1. Дайте определение химического равновесия. Особенности химического равновесия.
2. Дайте определение константы химического равновесия. От каких факторов зависит константа равновесия?
3. Приведите примеры гомогенной и гетерогенной обратимых химических реакций. Запишите выражения констант равновесия для этих реакций, используя различные способы выражения состава системы.
4.В гомогенной системе А +2В ↔2С равновесные концентрации веществ равны: сА=сВ=сС=0,2 моль/л. Вычислите константу равновесия и начальные концентрации веществ А и В.
Ответ:Кс = 5; сА=0,3 моль/л; сВ=0,4 моль/л.
5. Вычислите константу равновесия системы H2 + I2 ↔ 2 HI, если начальные концентрации водорода и йода равны 2 и 1,6 моль/л соответственно, а равновесная концентрация HI равна 2,4 моль/л.
Ответ: Кс = 18.
6. Константа скорости прямой реакции А + 2В ↔ 3С равна 0,5 л2/(моль2•с). Начальные концентрации сА= 3 моль/л; сВ = 4 моль/л. В результате реакции равновесная концентрация вещества В оказалась равна 1 моль/л. Найдите равновесную концентрацию вещества А и скорость прямой реакции в момент равновесия.
Ответ: сА = 1,5 моль/л; v = 0,75 моль/(л×с).
7. Константа равновесия реакции А + В ↔ С + D равна
единице. Сколько процентов вещества А подвергнется превращению, если смешать 4 моль вещества А и 6 моль вещества В?
Ответ: 60 %.
8. Найдите константу равновесия и равновесные концентрации всех участников реакции 2SO2(г) + O2(г) ↔2SO3(г) , если начальные концентрации оксида серы(IV) и кислорода составляли 4 и 2,5 моль/л соответственно, а к моменту равновесия прореагировало 25% SO2.
Ответ :Кс=0,055л/моль; 
9.Рассчитайте константу скорости реакции при температуре 430 К, если константа скорости реакции при температуре 357 К равна 10-6 л/(моль×с), а энергия активации реакции равна 190,9 кДж/моль.
Ответ: 0,055 л/(моль×с).
10. Сформулируйте принцип Лё Шателье.
11. В каком направлении сместится равновесие реакции
2SO2(г) + O2(г) ↔2SO3(г); ΔrH=-196,6 кДж
при а )увеличении температуры; б) увеличении концентрации SO2; в) уменьшении концентрации SO3; г) уменьшении парциального давления кислорода; д) увеличении общего давления?
Ответ:а)влево; б)вправо; в)вправо; г)влево; д)вправо.
12.Какие факторы способствуют смещению равновесия в системе СаСО3 ↔ СаО + СО2 вправо, если DrH0 > 0?Как повлияет на положение равновесия увеличение количества карбоната кальция?
13. Едкий натр растворяется в воде с выделением теплоты. Как влияет повышение температуры на растворимость гидроксида натрия?
