Химическая» энергия среди других видов энергии
Термодинамика – наука изучаюшая законы энергетики химических превращений, химических равновесий.
Термодинамика (от греч. 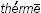 – тепло и
– тепло и 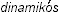 – силовой) – наука о закономерностях движения теплоты и превращения энергии. Одним из признаков движения теплоты в химических процессах является ее поглощение или выделение в ходе реакции. Все химические реакции по признаку поглощения или выделения теплоты можно разделить на два основных класса: эндотермические и экзотермические. Тепловая энергия – один из видов энергии.
– силовой) – наука о закономерностях движения теплоты и превращения энергии. Одним из признаков движения теплоты в химических процессах является ее поглощение или выделение в ходе реакции. Все химические реакции по признаку поглощения или выделения теплоты можно разделить на два основных класса: эндотермические и экзотермические. Тепловая энергия – один из видов энергии.
Конкретный объект термодинамического исследованияназывают термодинамической системой или просто системой, выделенной из окружающего мира реально существующими или воображаемыми поверхностями. Системой может быть газ в сосуде, раствор реагентов в колбе, кристалл вещества или даже мысленно выделенная часть этих объектов. Т.е. система – это совокупность тел. Термодинамическая система всегда сопоставляется внешней среде.
Для того чтобы систему можно было описать термодинамически, она должна состоять из большого числа частиц – соответствовать законам статистики.
Если в системе есть реальные поверхности раздела, отделяющие друг от друга части системы, различающиеся по свойствам, то система называется гетерогенной (насыщенный раствор с осадком), если таких поверхностей нет, система называется гомогенной (истинный раствор). Гетерогенные системы содержат не менее двух фаз.
Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам (не зависящим от количества вещества) и отграниченных от других частей системы поверхностью раздела. Внутри одной фазы свойства могут изменяться непрерывно, но на поверхности раздела между фазами свойства меняются скачком. Пример двухфазной системы – поверхность реки в ледоход.
Компонентами называют вещества, минимально необходимые для составления данной системы (минимум один). Число компонентов в системе равно числу веществ в ней присутствующих, минус число связывающих эти вещества независимых уравнений.
По уровням взаимодействия с окружающей средой термодинамические системы принято делить на:
– открытые – обмениваются с окружающей средой веществом и энергией (например, живые объекты);
– закрытые – обмениваются только энергией (например, реакция в закрытой колбе или колбе с обратным холодильником), наиболее частый объект химической термодинамики;
– изолированные – не обмениваются ни веществом, ни энергией и сохраняют постоянный объем (приближение – реакция в термостате).
Основные свойства системы (те, которые можно измерить) – объем, масса, температура, концентрация, давление, энергия.
Наиболее важны для расчетов – функции состояния – такие термодинамические функции, значения которых зависят только от состояния системы и не зависят от пути перехода между состояниями.
Процесс в термодинамике – это не развитие события во времени, а последовательность равновесных состояний системы, ведущих от начального набора термодинамических переменных к конечному. Термодинамика позволяет полностью решить поставленную задачу, если исследуемый процесс в целом описывается совокупностью равновесных стадий. Например, работа реактивного двигателя – это последовательность почти равновесных процессов в каждом малом сечении двигателя (быстрые реакции быстро устанавливают равновесие).
В расчетах используют численные данные (табличные) о термодинамических свойствах веществ. Даже небольшие наборы таких данных позволяют рассчитывать множество различных процессов. Для расчета равновесного состава не требуется записывать уравнения возможных химических реакций, достаточно учесть все вещества, которые могут в принципе составлять равновесную смесь.
Таким образом, химическая термодинамика не дает чисто расчетного (неэмпирического) ответа на вопрос "«почему?"» и тем более "«как?"» она решает задачи по принципу "«если ..., то ..."»
Для термодинамической системы характерны параметры состояния (переменные величины). Они зависят от основных свойств системы.
U – внутренняя энергия.
H – энтальпия.
S – энтропия.
G – изобарно-изотермический потенциал. Он включает в себя и H, и S, ещё называют энергия Гиббса.
Энергия Гиббса характеризует состояние системы и происходящих в ней изменениях.
F – изохорный потенциал.
Основная характеристика термодинамической системы – теплота.
Теплота – это количество энергии, передающееся путём хаотичного столкновения между молекулами. При затрате теплоты (энергии) система совершает определённую работу.
Работа (А) – это количество энергии, передающееся путём перемещения масс, при этом охватывается большое число молекул.
А = р ∙ (V2 – V1) = р ∙ Δ V
Обратимый термодинамический процесс –это процесс, который допускает возможность возвращения системы в первоначальное состояние без каких-либо изменений в окружающей среде. Обратимость и необратимость в термодинамике не совпадает с этими же понятиями в химических реакциях. Потому что обратимый процесс в термодинамике часто применяется к любым реакциям, если их поместить в изолированную систему.
Все термодинамические можно разделить на:
1) изохорный, V = const
2) изобарный, р = const
3) изотермический, T = const
4) адиабатический, Q = const (теплота).
Законы термодинамики
В большинстве курсов химической термодинамики рассматривается три закона.
Первый закон термодинамики – одна из форм закона сохранения энергии.
Его формулировки:
Энергия не создается и не уничтожается.
