Соль вода основание кислота
где М – металл, А – остаток кислоты (анион).
Соли, образованные сильными кислотами и сильными основаниями (например, NaCl, KNO3 и др.), гидролизу не подвергаются. Гидролиз характерен для солей, образованных: 1) слабой кислотой и сильным основанием, 2) сильной кислотой и слабым основанием, 3) слабой кислотой и слабым основанием. Приведем примеры.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение. а) Цианид калия KCN – соль слабой одноосновной кислоты HCN и сильного основания KOH. При растворении в воде молекулы KCN полностью диссоциируют на катионы K+ и анионы CN 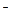 . Катионы K+ не будут связывать ионы OH
. Катионы K+ не будут связывать ионы OH 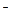 воды, так как KOH – сильный электролит, анионы же CN
воды, так как KOH – сильный электролит, анионы же CN 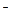 связывают ионы H+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
связывают ионы H+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
CN 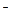 + H2O ⇄ HCN + OH
+ H2O ⇄ HCN + OH 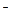
или в молекулярной форме
KCN + H2O ⇄ HCN + KOH
В результате гидролиза в растворе появляется некоторый избыток ионов OH 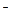 , поэтому раствор KCN имеет щелочную реакцию (pH>7).
, поэтому раствор KCN имеет щелочную реакцию (pH>7).
б) Карбонат натрия Na2CO3 – соль слабой многоосновной кислоты H2CO3 и сильного основания NaOH. В этом случае анионы соли CO 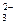 , связывая водородные ионы воды, образуют анионы кислой соли HCO
, связывая водородные ионы воды, образуют анионы кислой соли HCO 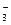 , а не молекулы H2CO3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
, а не молекулы H2CO3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO 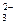 + H2O ⇄ HCO
+ H2O ⇄ HCO 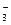 + OH
+ OH 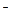
или в молекулярной форме
Na2CO3 + H2O ⇄ NaHCO3 + NaOH
В растворе появляется избыток ионов OH 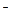 , поэтому раствор Na2CO3 имеет щелочную реакцию (pH>7).
, поэтому раствор Na2CO3 имеет щелочную реакцию (pH>7).
в) Сульфат цинка ZnSO4 – соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn2+ + H2O  ⇄ ZnOH+ + H+
⇄ ZnOH+ + H+
или в молекулярной форме
2ZnSO4 + 2H2O ⇄ (ZnOH)2SO4 + H2SO4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (pH< 7).
Пример 2. Какие продукты образуются при смешивании растворов Al(NO3)3 и K2CO3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль Al(NO3)3 гидролизуется по катиону, а K2CO3 – по аниону:
Al3+ + H2O ⇄ AlOH2+ + H+
CO 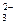 + H2O ⇄ HCO
+ H2O ⇄ HCO 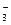 + OH
+ OH 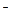
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы H+ и OH 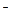 образуют молекулу слабого электролита H2O. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием Al(OH)3 и CO2 (H2CO3). Ионно-молекулярное уравнение:
образуют молекулу слабого электролита H2O. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием Al(OH)3 и CO2 (H2CO3). Ионно-молекулярное уравнение:
2 Al3+ + 3 CO 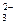 + 3H2O = 2Al(OH)3 + 3CO2
+ 3H2O = 2Al(OH)3 + 3CO2
молекулярное уравнение:
2 Al(NO3)3 + 3K2CO3 +3H2O = 2Al(OH)3 + 3CO2 + 6KNO3
Контрольные вопросы:
| 161.Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию. | |||
| 162.Kакое значение рН(>7<) имеют растворы следующих солей: Na3РО4, Cu(NO3)2, MnSO4? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
| 163.Какие из солей Na2SiO3, CdCl2, NaNO3, CoCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН(>7<) имеют растворы этих солей? | |||
| 164. При смешивании растворов FeCl3 и K2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. | |||
| 165. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2SO3 или Na2S, CdCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
| 166. Какое значение рН(>7<) имеют растворы солей NaNO2, CuCl2, MnSO4? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
| 167. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Cu(NO3)2, Na2S, SnSO4 . Какое значение рН(>7<) имеют растворы этих солей? | |||
| 168. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СН3СООNa, K3PO4, Fe(NO3)3. Какое значение рН(>7<) имеют растворы этих солей? | |||
| 169. При смешивании растворов Cr2(SO4)3 и Na2СО3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнения происходящего совместного гидролиза. | |||
170. Подберите по два уравнения в молекулярном виде к каждому из молекулярно-ионных уравнений: Fe3+ + 2H2O ⇄ [(Fe(OH)2]+ +2H+ CO 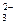 + H2O ⇄ HCO + H2O ⇄ HCO 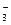 + OH- + OH- | |||
| 171. Какие из солей LiCl, Сr(NO3)3, Na2CO3, NiSO4 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН(>7<) имеют растворы этих солей? | |||
| 172. К раствору AlCl3 добавили следующие вещества: а) НNO3; б) NaОН; в) Na2SiO3; г) Pb(NO3)2. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. | |||
| 173. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na3PO4; FeСl3 или AlCl3? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
| 174. Какое значение рН(>7<) имеют растворы солей K2SO3, Pb(NO3)2, СuCl2? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. | |||
175.Подберите по два уравнения в молекулярном виде к каждому из молекулярно-ионных уравнений:  Al3+ + H2O ⇄ (AlOH)2+ + H+ S2- + H2O ⇄ HS- + OH- Al3+ + H2O ⇄ (AlOH)2+ + H+ S2- + H2O ⇄ HS- + OH- | |||
| 176. К раствору Na2S добавили следующие вещества: а) Н2SO4; б) KOH; в) Zn(NO3)2; г) К2CO3. В каких случаях гидролиз сульфида натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. | |||
| 177. Cоставьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов Na2S и ZnСl2. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. | |||
| 178. К раствору NiSO4 добавили следующие вещества: а) НNO3; б) NaОН; в) FeCl2; г) Na2S. В каких случаях гидролиз cульфата никеля усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. | |||
| 179. Какие из солей NiCl2, Na2CO3, ZnSO4, КСl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (>7<) имеют растворы этих солей? | |||
| 180. При смешивании растворов CrCl3 и K2SiO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. | |||
