Тема 2. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Для измерения масс атомов и молекул принята единица массы, равная 1/12 массы атома изотопа углерода 12 (612 С) и которая называется атомной единицей массы:
1 а.е.м. = (1/12).mA(612 С) = 1,66.10¯24 г = 1,66 10 -27 кг
Атомная масса (относительная атомная масса) )Аг - масса атома, выраженная в а.е.м.
Молекулярная масса (относительная молекулярная масса) Мг - масса молекулы, выраженная в а.е.м.
Мерой количества вещества в химии является моль.
Моль(n) - количество вещества, содержащее столько молекул, ионов, электронов и др. структурных (формульных) единиц, сколько содержится атомов в 12 г изотопа углерода 12 (612 С).
Число атомов в 12 г изотопа углерода равно 6,02.10- 23и называется числом Авогадро - NА.. Если известно число структурных единиц, можно рассчитать количество вещества по формуле:
n = N/ NA , где N - число структурных единиц (2.1)
Молярная масса(М) - масса одного моля вещества, выраженная в г/моль. Если известна масса вещества, можно рассчитать количество вещества по формуле:
М=m/n , где n – число молей вещества, m – масса вещества (2.2)
Молекулярная и молярная массы равны по величине, но отличаются единицами измерений.
Закон сохранения массы (Ломоносов М.В., Лавуазье А.):
Общая масса веществ, вступивших в реакцию, равна общей массе продуктов реакции.
Закон постоянства состава (Пруст Ж.):
Любое чистое вещество независимо от способа его получения, имеет постоянный качественный и количественный состав.
Закон кратных отношений (Дальтон Дж.):
Если два элемента образуют между собой несколько молекулярных соединений, то массовые количества одного элемента, приходящиеся на одно и то же массовое количество другого, соотносятся между собой как небольшие целые числа.
Закон объемных отношений(Гей-Люссак Ж.) :
Объемы вступающих в химическую реакцию газов и газообразных продуктов реакции относятся друг к другу как небольшие целые числа.
При расчетах реакций, протекающих с участием газообразных веществ, опираются на основные газовые законы.
Закон Авогадро(Авогадро А.):
В равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул.
Следствия закона Авогадро:
1-е следствие: 1 моль идеального газа при н.у. (Т = 273,15 K, Р = 101,3 кПа) занимает объем 22, 414 л. Этот объем называют молярным объемом газа - Vm.
Если известен объем газа, можно рассчитать количество вещества по формуле:
n = V/Vm , где V – объем газа (2.3)
2-е следствие: Массы газов, занимающих одинаковый объем, относятся между собой как их молярные массы:
m1/m2=M1/М2 (2.4)
где m1 и m2 – массы первого и второго газа, M1 и М2 - их молярные массы, соответственно.
С учетом рассмотренных выше основных понятий и законов количество вещества можно найти по соотношениям:
n =m/M=N/NA=V/Vm (2.5)
Задача 1. Вычислите молярную массу газа, если масса 600 мл его при нормальных условиях равна 1,714 г.
Решение: используя соотношения (2.5) m/М = V/Vm вычислим молярную массу газа:
Мгаза=(1,714·22,4)/0,6 = 64 г/моль
Задача 2.Сколько молекул содержится в 8 г кислорода?
Решение: используя соотношение (2.5) находим N:
m/М = N/NA, где m - масса кислорода, М -молярная масса кислорода, N - число структурных единиц (молекул), NA - число Авогадро.
N = 8·6,02·1023/32 = 1,5∙1023 молекул
Отношение молярной массы первого газа к молярной массе второго газа при одинаковых условиях называется относительной плотностью:
D= М1/М2 (2.6)
Формулы относительной плотности газов по водороду и воздуху имеют следующий вид:
D Н2 = М газа/2 - относительная плотность газа по водороду (2.7)
Dвозд.= М газа/29 - относительная плотность газа по воздуху (2.8)
где 2 и 29 - средние молярные массы (г/моль) водорода и воздуха, соответственно.
Задача 3. Вычислите относительную плотность диоксида азота(IV) (NO2) по водороду и воздуху.
Решение: Определяем молярные массы газов:
Mн2=2 г/моль;MNO2=46 г/моль; Мвоздуха=29 г/моль
Используя формулы (2.7) и (2.8), находим относительную плотность NO2:
DH2= 46/2=23; Dвозд= 46/29=1,58
Задача 4. Во сколько раз газообразный бром тяжелее воздуха?
Решение: Используем соотношение (2.8):
D возд. =М газа/ 29
где М газа - молярная масса газообразного брома.
Находим молярную массу газообразного брома и подставляем ее значение в выражение относительной плотности по воздуху: .
Мгаза= 80·2 = 160 г/моль
D возд. = 160/ 29 = 5,5
Закон Бойля-Мариотта (Бойль Р., Мариотт Э.):
При постоянной температуре объем данного количества газа обратно пропорционально давлению, под которым он находится:
p1V1 = p2V2 (2.9)
Задача 5. При некоторой температуре давление газа (Р1) равно 760 мм. рт. ст. (105 Па), а объем газа равен 2л. Каким станет давление газа (Р2), если увеличить его объем до 5л, при постоянной температуре?
Решение: используя закон Бойля-Мариотта (2.9), выражаем Р2:
P2=P1·V1/V2= 100кПа·2л/5л = -40кПа.
Закон Гей-Люссака (Гей-Люссак Ж.):
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V1/V2= Т1/Т2 или V/T=const (2.10)
При постоянном объеме давление газа изменяется прямо пропорционально температуре
Р1/Р2= Т1/Т2 или Р/Т = const (2.11)
Задача 6. При 7ºС давление газа (Р1) в закрытом сосуде равно 96,0 кПа. Каким станет давление (Р2), если охладить сосуд до - 33ºС?
Решение: переводим значения температур по шкале Кельвина ( Т1 и Т2) и используя (2.11) выражаем Р2:
Т1=273К+ 7ºС= 280К; Т2= 273К - 33º=240К
Р2=96· 240/280= 82,3 кПа.
Последние два закона часто выражают формулой объединенного газового закона:
P1·V1/Т1 = P2·V2/Т2 (2.12)
где Р, V и Т - давление, объем и температура данного количества газа.
Если в выражение (2.12) подставить значения р, V и Т, соответствующие 1 молю идеального газа при нормальных условиях, то соотношение рV/Т станет постоянным, его обозначают R и называют универсальной газовой постоянной, численное значение которой в системе СИ равно: R= 101,325(кПа)· 22,40 (л/моль)/273 К = 8,314 кПа·л/моль·К = 8314 Дж /моль·К. Объединенный газовый закон для 1 моль газа называют уравнением состояния идеального газа и записывают следующим образом:
pV=RT (2.13)
Если количество газа отлично от 1 моль, то уравнение называется уравнениемКлайперона – Менделеева и принимает вид:
pV=nRT=m/M·RT (2.14)
где n - число молей данного газа.
Задача 7. Рассчитайте объем 10 кг О2 при давлении 15 МПа и температуре 20 ºС.
Решение: Используя формулу (2.14) выражаем искомый объем кислорода :
V=mRT/MP=10·103(г)·8,314(кПа·/моль·К)·293(К)/32(г/моль)·1500(кПа)=50,75 л
Закон парциальных давлений (Дальтон Дж.):
Общее давление смеси газов, химически не взаимодействующих между собой, равно сумме их парциальных давлений:
P=∑Pi (2.15)
Парциальное давление Pi - давление i-го газа, входящего в состав смеси, которое создавал бы этот газ, если бы он один при этой же температуре занимал объем, равный объему всей смеси.
Состав газовых смесей может выражаться массовыми и объемными долями, молярными долями:
1)массовая доля газа: ωn=mn/m, где mn- масса данного газа, m - масса смеси газов;
2)объемная доля газа: φn=Vn/V, где Vn- объем данного газа, V - объем смеси газов;
3)молярная доля газа, γ= ni /∑ni где ni - число молей данного газа, ∑ni общее число молей газов, составляющих данную газовую смесь.
Задача 8. В баллоне объемом 10-2 м3 при 18º находится 14·10-3 кг кислорода и 12·10-3 кг аммиака. Определите парциальное давление каждого газа в смеси.
Решение: используем уравнение Клайперона – Менделеева(2.14), преобразовав его следующим образом:
p=(m/MV)RT
По преобразованной формуле находим парциальное давление кислорода и аммиака:
PO2=14∙10-3∙8,314∙103∙291/32∙0,01=106∙102 Па
PNH3=12∙10-3∙8,314∙103∙291/17∙0,01=171∙103 Па
При необходимости расчета давления смеси газов определяют парциальные давления отдельных газов (см. задачу 8), а затем общее давление по формуле закона Дальтона (2.15).
Наиболее часто при количественных расчетах используют закон эквивалентов.
Химический эквивалент (Э) - реальная или условная часть вещества, которая соответствует (эквивалентна) одному атому или иону водорода, т.e. либо соединяется с одним атомом или ионом водорода, либо замещает его в обменных реакциях.
Например, в реакции:
2HCl +Ca(OH2)→CaCl2+2H2O
двум ионам водорода в HCl соответствует одна молекула Са(ОН)2, следовательно, одному иону водорода эквивалента половина молекулы Са(ОН)2. Это и будет химическим эквивалентом гидроксида кальция в данной реакции: Э(Са(ОН)2)=1∕2 Са(ОН)2
Химический эквивалент - безразмерная величина. Для вышеприведенной реакции число 1/2 называется фактором эквивалентности и обозначается f(экв)(Са(ОН2)).
Фактор эквивалентности - доля вещества, эквивалентная одному атому или иону вoдopoдa:
fэкв =1/z, где Z-число замещенных или присоединенных ионов водорода или абсолютное значение степени окисления элемента.
Фактор эквивалентности может быть равен или меньше единицы. Для различных классов соединений фактор эквивалентности можно определить по формулам:
для кислот fэкв =1/n, где n-число атомов водорода (основность);
для оснований fэкв =1/n, где n-число атомов металла;
для солей fэкв =1/(n* B), где n-число атомов металла; В-валентность металла или неметалла.
Кроме того, можно определить фактор эквивалентности элемента в соединении по формуле:
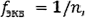
где n - абсолютное значение степени окисления элемента в данном соединении.
Например, в соединении KMnO4 факторов эквивалентности марганца равен l/7, так как степень окисления марганца равна +7.
Задача № 9. Определить фактор эквивалентности кислоты и щелочи в реакции:
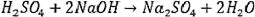
Решение: По реакции двум ионам водорода молекулы серной кислоты соответствуют две молекулы гидроксида натрия, следовательно fэкв (H2S04)= 1/2, т. к. ½ часть молекулы серной кислоты отдает для реакции один ион водорода;
fэкв (NaOH)=1, т.к. одна молекула NaOH соединяется с одним ионом водорода;
Э(Н2SО4) = 1/2 H2SO4; химический эквивалент кислоты в данной реакции - условная частица, равная половине молекулы серной кислоты;
Э(NаОН) = l NaOH; химический эквивалент щелочи в данной реакции - условная частица, равная одной молекуле гидроксида натрия.
Фактор эквивалентности одного и того же вещества в разных реакциях может быть различным.
Рассмотрим реакцию нейтрализации: Н3РО4 + 3КОН →К3РО4 + 3Н2О, в которой три иона водорода замещаются на ионы калия. 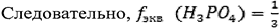
Если в реакции происходит неполное замещение по уравнению:
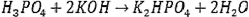
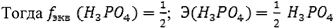
Наконец, если взаимодействие идет по уравнению:
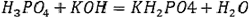
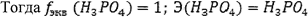
Для эквивалентов можно рассчитать молярную массу и количество вещества.
Молярная масса химического эквивалента вещества Х - M(Эx) - масса одного моля химического эквивалента этого вещества, равная произведению фактора эквивалентности fэкв(Х) на молярную массу вещества М (Х):
М(Эх) = f экв (Х) * М(х). (2.16)
Молярная масса химического эквивалента вещества Х численно равна прежнему понятию эквивалентная масса (г - экв).
Количество вещества химического эквивалента (в моль) n (Эх) - отношение массы вещества Х к молярной массе его химического эквивалента:
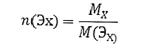 (2.17)
(2.17)
Количественные соотношения между химическими эквивалентами веществ, участвующих в реакции, задаются законом эквивалентов: химические вещества соединяются друг с другом или замещают друг друга в количествах, пропорциональных их молярным массам эквивалента
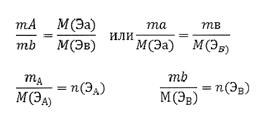 (2.18)
(2.18)
При взаимодействии веществ должно соблюдаться равенство согласно закону эквивалентов:
n(ЭA) = n(ЭВ) (2.19)
Когда одно из реагирующих веществ находится в газообразном состоянии, закон эквивалентов принимает вид:
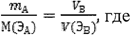 (2.20)
(2.20)
mА-масса твердого вещества А,
М(ЭA)- молярная масса эквивалента вещества А,
VB-объем газообразного вещества А,
V(ЭВ)-объем молярной массы химического эквивалента газообразного вещества В.
Объем молярной массы химического эквивалентагазообразного вещества равен произведению фактора эквивалентности на молярный объем:
V(Эх)fх · Vm, где Vm-мольный объем (22,4 л).
Для кислорода: V(ЭО2) = 1/4∙22,4 = 5,6л
Для водорода: V(ЭН2) = 1/2∙ 22,4 = 11,2л
Задача № 10.При растворении в кислоте 3,06г металла выделилось 2,8л водорода, измеренного при н.у. Вычислить молярную массу химического эквивалента металла.
Решение: Для решения задачи используем закон эквивалентов, когда одно из реагирующих веществ находится в газообразном состоянии:
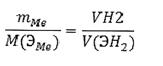 (2.21)
(2.21)
Для водорода фактор эквивалентности составляет l/2, следовательно, при н.у. : V(ЭН2) = 11,2л.
Из закона эквивалентов выражаем молярную массу химического эквивалента металла: М(ЭМе) = mMe ·V(ЭН2)/VН2 =3,06·11,2/ 2,8 = 12,24 г/моль
Задача № 11. Фактор эквивалентности серной кислоты в реакции с гидроксидом натрия равен 1/2. Какая масса гидроксида натрия потребуется для реакции с серной кислотой массой 19,6 г?
Решение: Для гидроксида натрия фактор эквивалентности равен:
fэкв(NaОН) = 1
Следовательно, молярная масса химического эквивалента гидроксида натрия согласно (2.16) равна:
М(ЭNaOH) = fэкв (NaOH)∙М(NаОН) = 1·40 =40 г/моль
Молярная масса химического эквивалента серной кислоты:
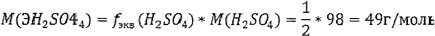
Из закона эквивалентов (2.18) выражаем массу гидроксида натрия:
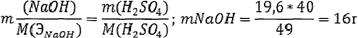
Лабораторная работа № 2
